🔬【JACS】突破双重细菌防线!一种3K脂肽如何实现对8类多菌感染的全面杀灭
文章信息
📚文章标题:A Bioinspired Lipopeptide Surmounts Therapeutic Dilemmas of Gram-Positive and Gram-Negative Polymicrobial Infection 作者:Xianghui Xu* 等 期刊:Journal of the American Chemical Society 链接:https://doi.org/10.1021/jacs.5c10219
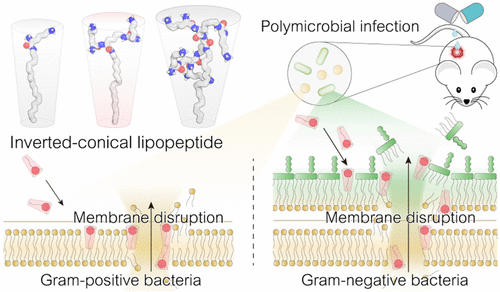
近年来,革兰氏阳性菌与革兰氏阴性菌共同引发的多菌感染(polymicrobial infection)成为临床治疗的重大难题。传统抗生素往往对其中一类细菌有效,却对另一类无能为力,导致治疗失败、耐药性上升。本文介绍了一项来自《美国化学会志》的最新研究成果:一种名为LP 3K的生物仿生脂肽,成功打破这一治疗瓶颈,在体内外均展现出卓越的广谱抗菌能力与安全性 1。
🧫1种脂肽,对抗8种临床常见病原菌
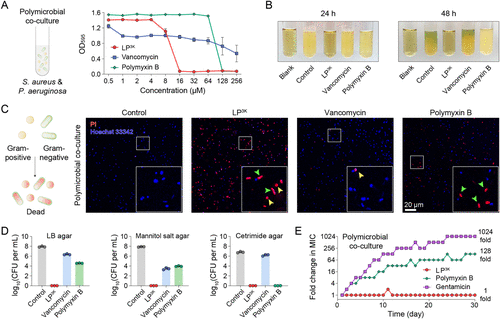
研究团队以天然脂类为启发,筛选出具有膜破坏能力的脂质骨架,并通过化学优化设计出三代脂肽LP 1K、LP 3K与LP 7K。其中LP 3K表现最为优异,能在16 μM浓度下杀灭包括金黄色葡萄球菌(S. aureus)、铜绿假单胞菌(P. aeruginosa)、肺炎克雷伯菌(K. pneumoniae)等在内的8种ESKAPE病原菌及临床分离菌株。
相比之下,传统抗生素如万古霉素(Van)和多粘菌素B(PmB)在多菌共培养条件下的最低抑菌浓度(MIC)均高于256 μM,远远落后于LP 3K的表现。
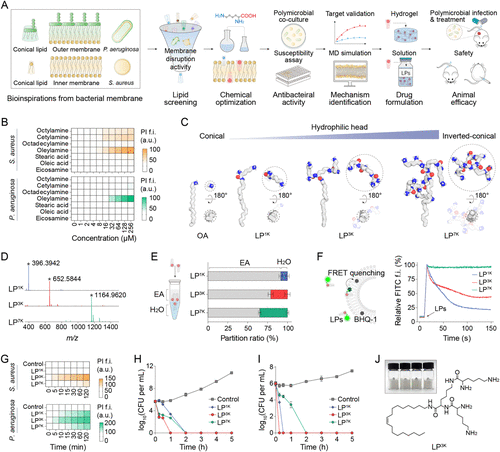
🧬结构优化:从OA到3K的“脂肽进化”
研究起点是脂质分子OA(Oleylamine),其具有一定的膜破坏能力,但抗菌活性弱、水溶性差。为此,研究者以OA为核心,引入赖氨酸(K)构建树枝状肽链,形成“倒锥形”结构的脂肽分子。
- LP 1K:单个赖氨酸修饰,形状接近OA
- LP 3K:三代赖氨酸修饰,形成理想的倒锥形
- LP 7K:七代修饰,水溶性强但膜插入能力下降
分子动力学模拟显示,LP 3K能稳定插入革兰氏阳性与阴性菌的内外膜,形成多达13个氢键,实现高效膜破坏。
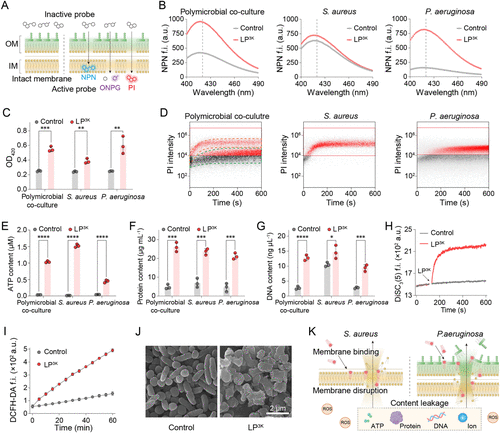
🧪多维机制验证:从膜破坏到DNA结合
研究通过多种实验手段验证LP 3K的抗菌机制:
- PI染色与流式细胞术:快速穿透细菌膜,导致细胞死亡
- NPN与ONPG探针:同时破坏外膜与内膜
- ATP、蛋白质、DNA泄漏:证明细胞内容物大量流失
- ROS探针与膜电位检测:诱导氧化应激与膜去极化
- SEM扫描电镜:观察到细菌形态崩解
- DNA结合实验:LP 3K可与细菌基因组DNA结合,进一步抑制生物合成
这些机制共同作用,使LP 3K在30分钟内彻底杀灭多菌混合培养物,远优于传统抗生素。 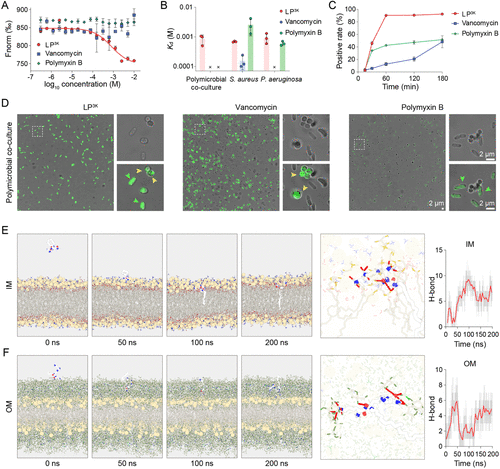
🐭体内验证:伤口模型中实现90倍杀菌效果
在小鼠皮肤伤口感染模型中,研究者将LP 3K加载于温敏水凝胶中进行局部治疗。结果显示:
- LP 3K组细菌负荷仅为4.39 × 10⁵ CFU/g,远低于万古霉素(1.86 × 10⁷)和多粘菌素B(4.16 × 10⁷)
- 伤口愈合率达93.67%,显著高于其他组
- 组织切片显示LP 3K组炎症减轻、胶原沉积增加,皮肤结构恢复良好
此外,LP 3K在体内外均未表现出明显毒性,无红细胞溶解、无细胞凋亡、无器官损伤,具备良好的生物安全性。 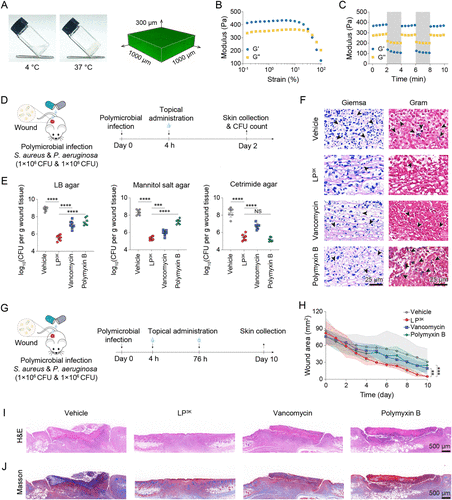
🛡️耐药性测试:30天无耐药突变
在连续30天的亚MIC浓度培养中,LP 3K未诱导任何耐药性突变,而多粘菌素B与庆大霉素的MIC分别上升了128倍与1024倍。这一结果凸显了LP 3K在长期治疗中的优势。 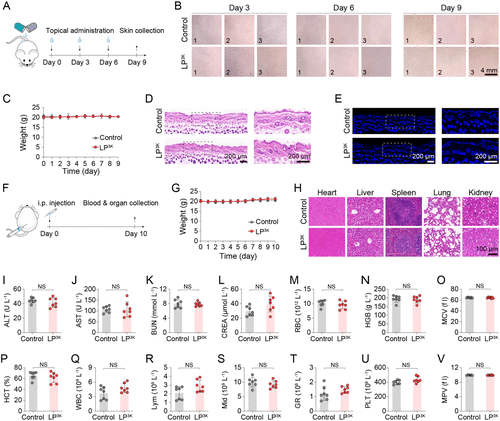
📌结语:脂肽抗菌的未来已来
本研究不仅提出了一种新型广谱抗菌分子LP 3K,更系统揭示了其结构优化路径与多维杀菌机制。其在体内外的卓越表现、广谱抗菌能力、低耐药性与高安全性,使其成为未来多菌感染治疗的有力候选。
在抗生素耐药性日益严峻的背景下,LP 3K的出现为临床治疗带来了新的希望,也为抗菌药物设计提供了重要的结构启示。
想了解更多研究细节,可查阅原文:JACS期刊文章