🚀【Nat. Biomed. Eng】突破CAR-T制造瓶颈:一项涵盖6大阶段、13项代谢指标的创新研究
[!INFO] ✨文章标题:Label-free metabolic imaging monitors the fitness of chimeric antigen receptor T cells ✉️作者:Capitini, Krishanu Saha & Melissa C. Skala 等 📚期刊:Nature Biomedical Engineering 🔗链接:https://doi.org/10.1038/s41551-025-01504-7
在细胞治疗领域,嵌合抗原受体T细胞(CAR-T)疗法已在血液肿瘤中取得显著成效,但在实体瘤治疗中仍面临诸多挑战。近日发表于《Nature Biomedical Engineering》的研究,通过一种无标记、非侵入式的光学代谢成像(Optical Metabolic Imaging, OMI)技术,系统揭示了CAR-T细胞在制造过程中的代谢动态,为优化制造流程、提升疗效提供了全新思路。
🔬从制造到疗效:CAR-T细胞的6大关键阶段
CAR-T细胞的制造流程复杂,主要包括以下六个阶段:
- T细胞激活:通过抗体刺激启动细胞周期。
- 基因转导:引入CAR基因,常用病毒或CRISPR/Cas9方法。
- 扩增培养:扩大细胞数量以满足治疗剂量。
- 代谢调控:调节营养物质和细胞因子以维持细胞活性。
- 表型塑造:通过培养条件影响细胞分化状态。
- 临床输注前评估:检测细胞代谢和表型,预测疗效。
每一阶段的代谢状态都影响最终的治疗效果,而传统检测方法往往无法实时、单细胞地捕捉这些变化。
🧪13项代谢指标+1项形态参数:OMI技术的强大解析力
OMI技术通过检测细胞内两种代谢共酶——NAD(P)H和FAD的自发荧光强度与寿命,构建了13项代谢参数和1项细胞质大小指标。这些参数可反映:
- 细胞氧化还原状态(如红氧比)
- 能量代谢路径(糖酵解 vs 氧化磷酸化)
- 细胞周期进程(如S/G2/M期比例)
- 代谢活性与分化状态(如线粒体质量)
研究发现,NAD(P)H寿命降低、自由态比例升高,通常代表细胞进入糖酵解状态,提示其处于活跃增殖期。
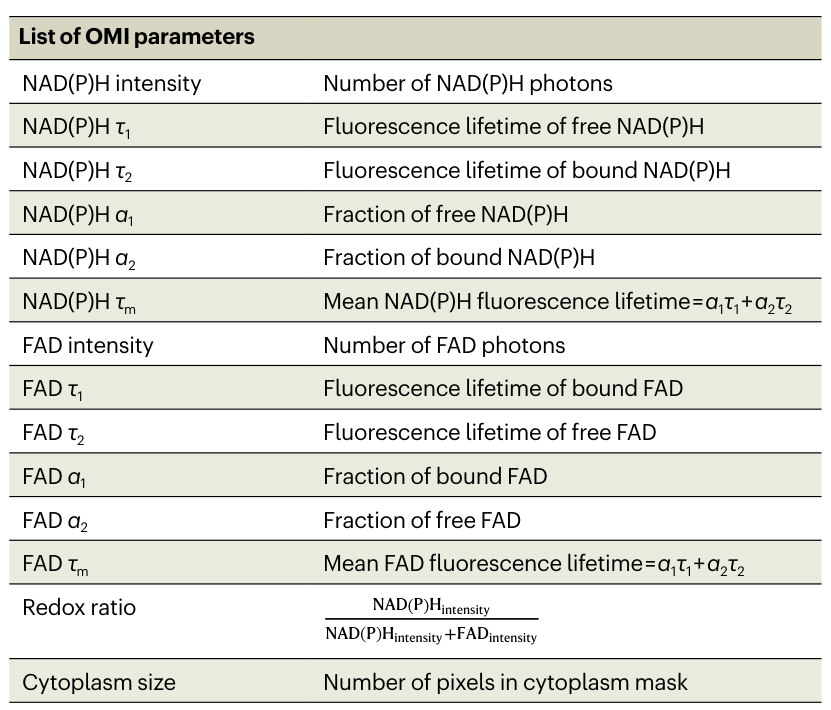
🧬激活条件决定代谢节奏:培养基比抗体更关键
研究对比了两种常用培养基(ImmunoCult XF和TexMACS)和两种激活抗体组合,发现:
- 培养基成分决定代谢变化的速度和强度:ImmunoCult XF(高葡萄糖/高谷氨酰胺)诱导更快、更强的代谢重编程。
- 激活后48小时是代谢峰值期:尤其在ImmunoCult XF中,NAD(P)H自由态比例显著升高。
- ATP产量与代谢指标高度一致:验证了OMI的准确性。
此外,无论使用可溶性抗体还是Dynabeads,培养基的影响始终占主导地位。
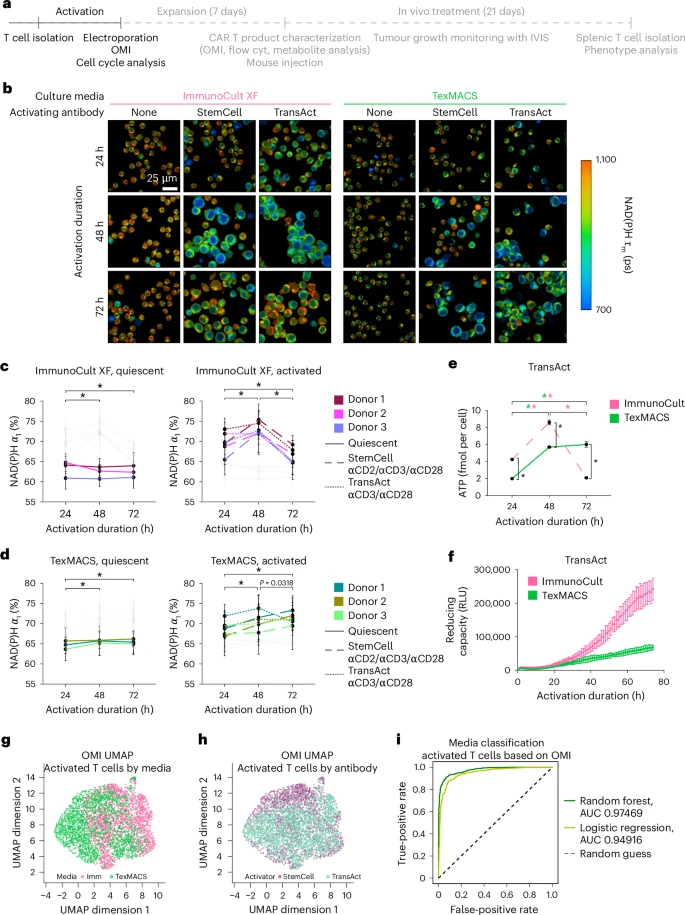
🧫代谢状态预测基因转导效率:CRISPR与病毒转导均适用
研究进一步发现,OMI参数可准确预测CAR基因转导效率:
- 低NAD(P)H寿命、高自由态比例的T细胞在转导时具有更高的基因整合率。
- 最佳转导时间窗口:ImmunoCult XF中为激活后36–60小时,TexMACS中为48–72小时。
- 机器学习模型预测准确率达83%,优于传统流式细胞术(AUC仅为74%)。
这意味着,OMI可用于实时判断何时进行基因编辑,以最大化CAR-T产量。
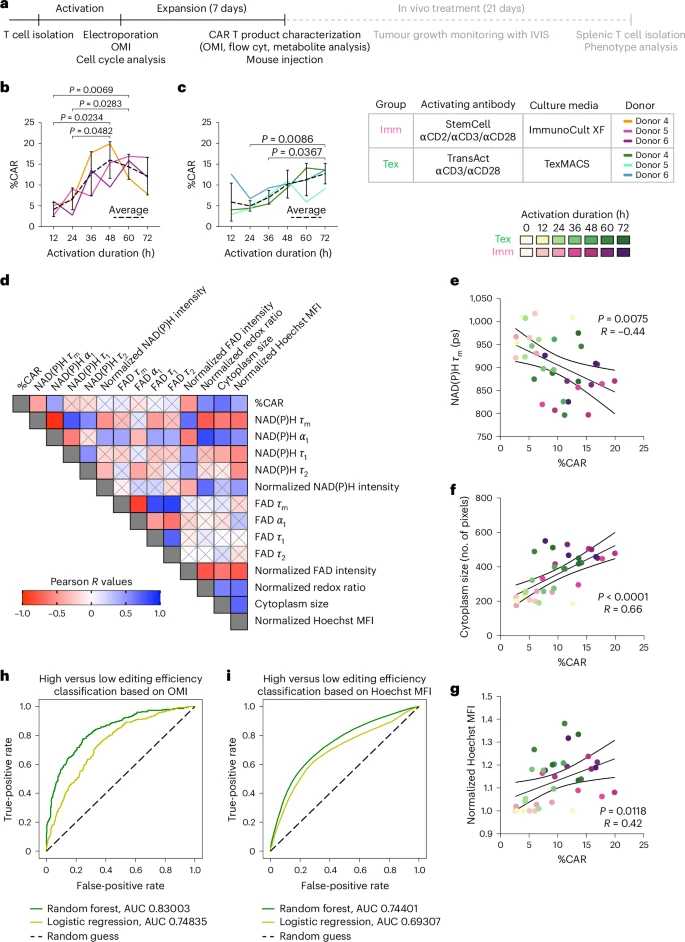
🧬扩增阶段的培养基转换:提升代谢适应性与疗效
研究尝试在扩增阶段进行培养基转换(TexMACS → ImmunoCult XF),发现:
- 代谢特征显著改变:NAD(P)H寿命升高,自由态比例下降,提示向氧化代谢转变。
- 乳酸分泌减少:表明糖酵解活性降低。
- CCR7+干性表型比例增加:与长期体内存活能力相关。
这种“代谢重塑”策略使CAR-T细胞更适应实体瘤微环境中的营养匮乏与代谢压力。
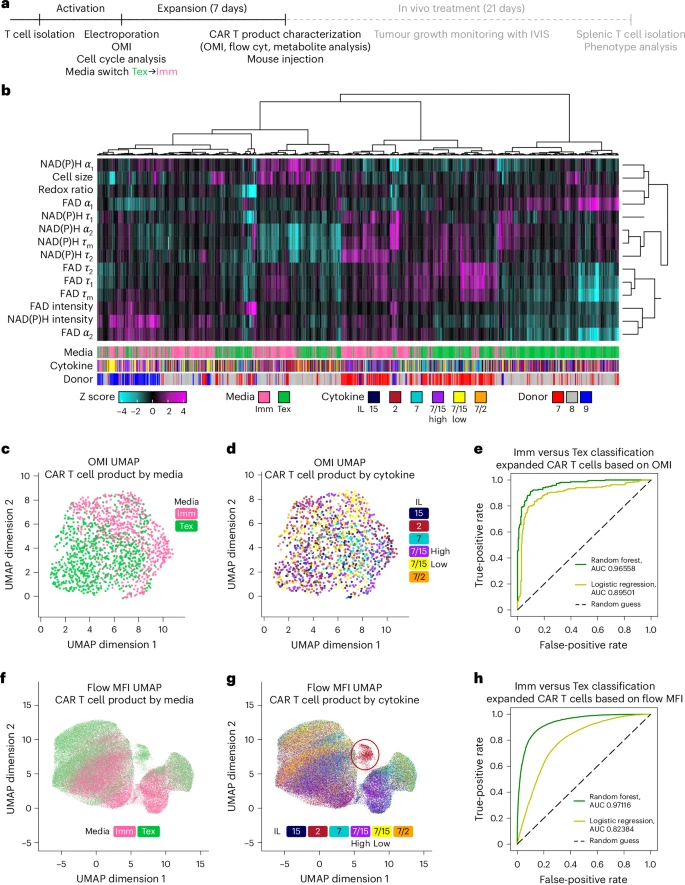
🧠OMI预测体内疗效:AUC高达91%
在神经母细胞瘤小鼠模型中,Tex→Imm条件下扩增的CAR-T细胞表现出更强的抗肿瘤能力:
- 肿瘤消退率更高:部分小鼠实现完全缓解。
- 体内干性表型保持更好:CCR7+/CD62L+比例更高。
- OMI参数可预测疗效:机器学习模型区分高低效CAR-T产品的准确率达91%。
这为CAR-T细胞的质量控制和个性化制造提供了强有力的工具。 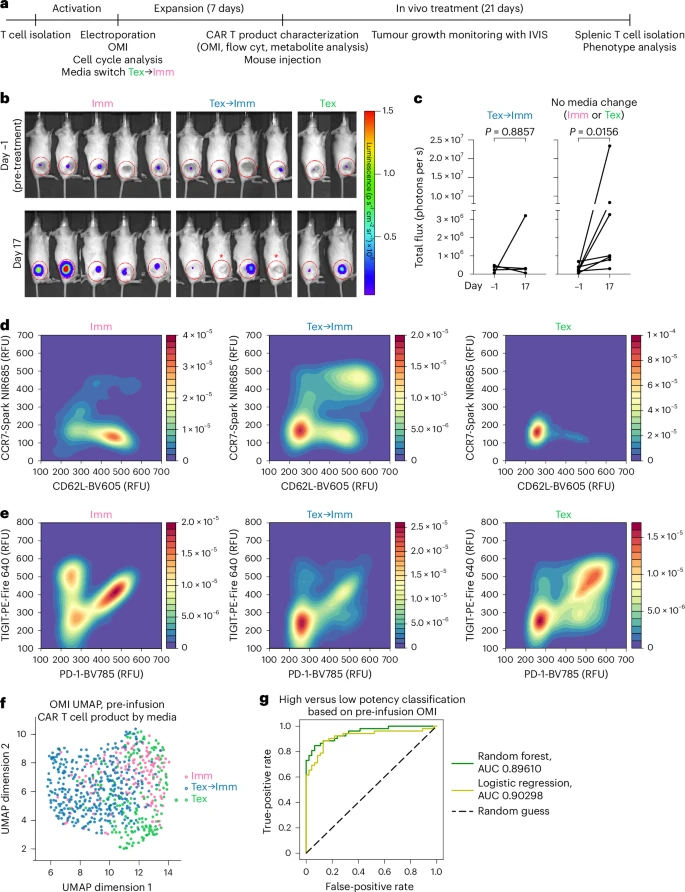
📌结语:OMI开启CAR-T制造智能化新纪元
本研究首次系统性地将OMI技术应用于CAR-T细胞制造全过程,覆盖从激活到输注前的多个阶段,揭示了代谢状态与功能之间的深度关联。其优势包括:
- 非侵入式、无标记、实时监测
- 单细胞分辨率,识别关键亚群
- 可与机器学习结合,预测制造结果与临床疗效
未来,OMI有望成为CAR-T制造流程中的标准化监测工具,推动实体瘤治疗的临床转化。