🚀【JACS】突破5.3倍线粒体富集瓶颈:一种新型砷药物精准递送策略引领癌症免疫治疗新纪元
[!INFO] ✨文章标题:Pretargeted Mitochondrial Delivery of Organoarsenicals for Cancer Immunotherapy ✉️作者:Yingxia Li,Hong Liu,Deju Ye 等 📚期刊:Journal of the American Chemical Society 🔗链接:https://doi.org/10.1021/jacs.5c12201
癌症治疗的精准化与高效性一直是生物医学领域的核心挑战。近期发表于《美国化学会志》(JACS)的一项研究提出了一种创新性的“线粒体预靶向递送”策略,成功实现了三价有机砷药物在肿瘤线粒体中的高效富集,不仅提高了治疗效果,还显著降低了系统毒性。本文将对该研究进行详细解读,帮助读者理解其机制、优势及未来应用前景。
🎯研究背景:线粒体与砷药物的治疗潜力
线粒体作为细胞能量代谢和程序性死亡的核心器官,在癌细胞中常表现出功能异常,如活性氧(ROS)升高、代谢重编程等。这些特性使线粒体成为肿瘤治疗的理想靶点。
三价砷(As(III))类药物,如三氧化二砷(ATO),已被批准用于治疗急性早幼粒细胞白血病。相比无机砷,有机砷化合物具有更好的生物相容性和药理可调性,其中达利帕新(darinaparsin)在治疗外周T细胞淋巴瘤方面表现出良好疗效。然而,这类药物在临床应用中仍面临系统毒性高、肿瘤选择性差等问题。 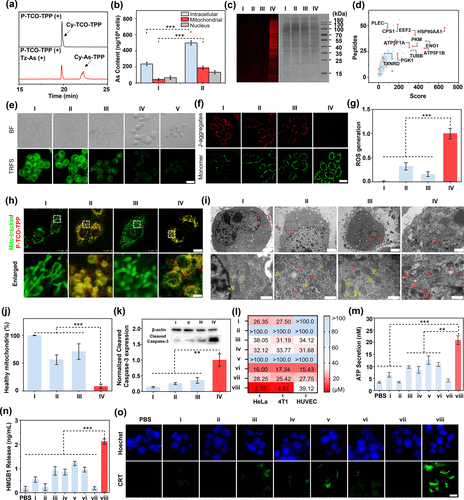
🧪两步式策略:精准递送的关键设计
研究团队设计了一种两步式的预靶向策略,核心包括两个分子:
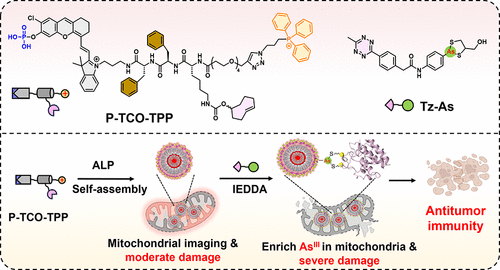
第一步是注射P-TCO-TPP探针,它是一种碱性磷酸酶(ALP)响应的小分子,含有磷酸保护的近红外荧光团、TCO基团和线粒体靶向的TPP阳离子。在肿瘤组织中,ALP催化去磷酸化后,该探针自组装形成荧光纳米颗粒Cy-TCO-TPP NPs,并通过TPP介导的阳离子作用实现细胞摄取、溶酶体逃逸和线粒体定位。
第二步是注射Tz-As药物,它是一种含有Tz基团和As(III)-二硫烷结构的有机砷化合物。Tz-As进入肿瘤细胞并扩散至线粒体,与Cy-TCO-TPP NPs中的TCO基团发生快速的反电子需求Diels–Alder(IEDDA)反应,形成Cy-As-TPP NPs,实现线粒体内的砷药物富集。 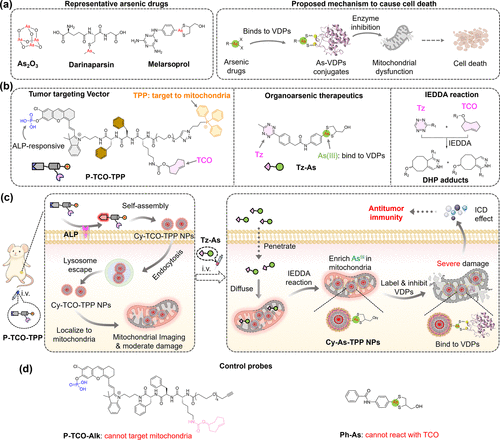
🔬机制验证:线粒体功能破坏与免疫激活
该策略使线粒体砷含量提升了5.3倍,细胞总摄取量提升2倍。研究通过多种手段验证了该策略的有效性:
Cy-As-TPP NPs可与线粒体中的邻位二硫醇蛋白(VDPs)共价结合,抑制关键酶如硫氧还蛋白还原酶(TrxR),导致线粒体膜电位丧失、ROS升高(约4.8倍)、形态改变(肿胀、圆形化)及超过80%的结构损伤。这些变化最终诱导了细胞凋亡和免疫原性死亡(ICD),包括ATP分泌增加2.1倍、HMGB1释放增加2.4倍以及膜表面钙网蛋白(CRT)暴露增强。 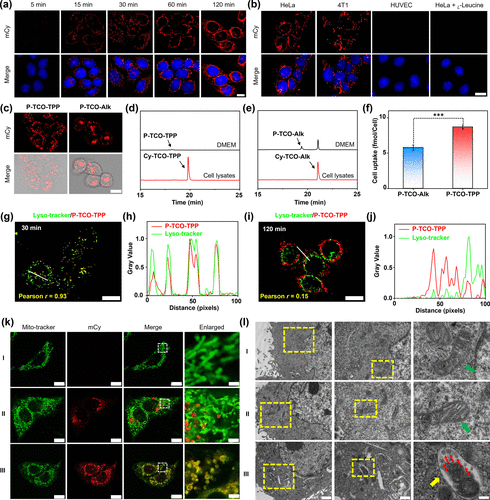
🐭动物实验:肿瘤抑制与毒性降低
在HeLa皮下肿瘤模型中,预靶向治疗组肿瘤体积显著缩小至约31 mm³,而单药治疗组肿瘤体积增长超过10倍。体重变化显示Tz-As单药组出现8%的体重下降,而预靶向组无明显毒性。
在更具挑战性的4T1乳腺癌原位模型中,预靶向组肿瘤几乎停止生长,存活时间延长至54天,肺部转移结节显著减少,免疫激活显著增强,成熟树突状细胞比例提升至45.57%,CD4⁺和CD8⁺ T细胞分别提升至27.17%和20.81%,Treg细胞比例下降至8.62%。 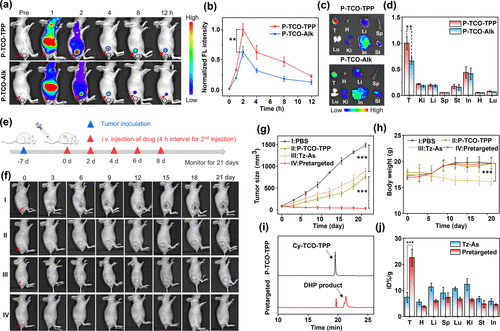
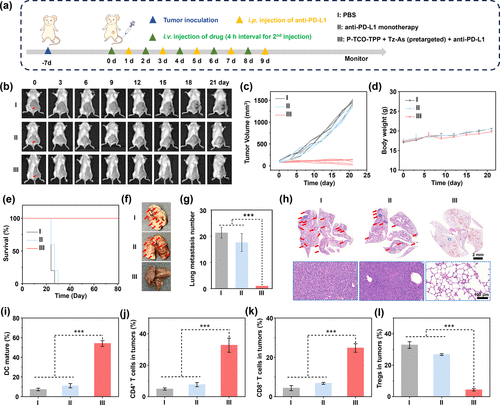
💉联合免疫治疗:40%小鼠实现完全肿瘤消退
由于预靶向治疗诱导PD-L1表达上调,研究进一步联合抗PD-L1免疫检查点抑制剂进行治疗。结果显示,40%的小鼠实现肿瘤完全消退,存活时间延长至81天。联合治疗显著增强了免疫激活效果,成熟DC细胞比例提升至54.12%,CD4⁺和CD8⁺ T细胞分别提升至32.70%和24.72%,Treg比例下降至4.33%,肺部转移几乎完全被抑制。 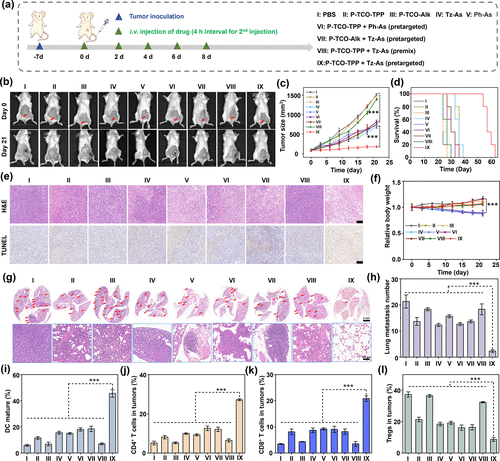
🧭总结与展望:精准递送的未来方向
该研究提出的两步式线粒体预靶向策略,不仅解决了传统砷药物治疗中的选择性与毒性难题,还通过诱导免疫原性死亡和增强免疫反应,为癌症治疗开辟了新路径。该策略具有良好的通用性和可扩展性,未来可用于递送其他类型的细胞毒性药物,甚至结合更多免疫治疗手段,进一步提升治疗效果。
尽管该策略在ALP阳性肿瘤中表现优异,但仍需解决ALP阴性肿瘤的靶向问题。未来研究可通过双靶点设计或优化药物动力学进一步提升选择性与安全性。这项工作不仅为砷药物治疗开辟了新路径,也为线粒体靶向药物递送和肿瘤免疫治疗提供了可推广的技术平台,值得在临床前研究中进一步探索。