【JACS】氟化核糖核苷酸颗粒实现高效髓系细胞mRNA递送和蛋白表达
简介
核酸疗法正迅速发展,但由于递送效率和低体内表达水平的限制,其在疫苗开发、免疫抑制和免疫刺激方面的应用受限。本研究创新性地开发了一种氟化核糖核苷酸颗粒(RNC),基于环糊精纳米颗粒,能够实现超高效的mRNA递送和蛋白表达,尤其针对髓系细胞。 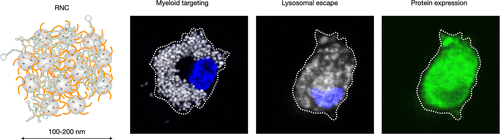
摘要
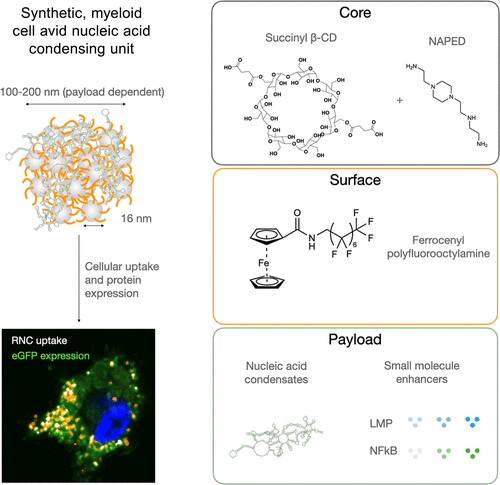
本文设计并合成了一种基于β-环糊精纳米颗粒的氟化核糖核苷酸颗粒(RNC),具备凝聚mRNA、实现溶酶体逃逸和免疫刺激的能力。该颗粒通过添加氟化物(FPFO或FTFE)显著提高转染效率,并成功实现肿瘤相关髓系细胞的高效靶向。实验显示,该平台在疫苗开发、免疫治疗等方面具有广泛应用前景。
研究结果与讨论
高效递送与髓系细胞激活设计
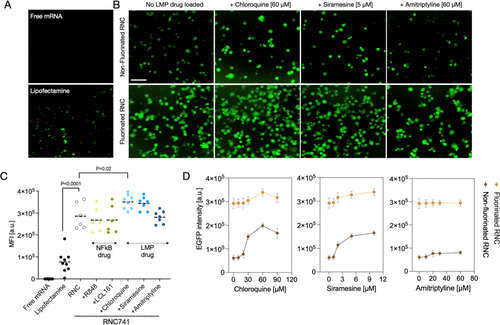
通过氟化表面修饰,显著提高了RNC的转染效率。FPFO修饰颗粒优于FTFE,在载药容量和稳定性方面表现突出,使用NAPED作为质子化交联剂实现高效mRNA封装。
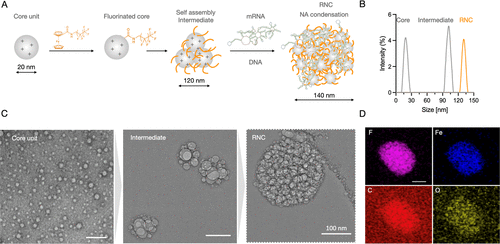
RNC颗粒特性
实验表明,RNC组装后的颗粒大小为137nm(mRNA载体)至215nm(pcDNA载体),具有一致的多分散指数和正电荷。通过CryoEM和EDS分析,证实了其均匀分散和组成稳定性。
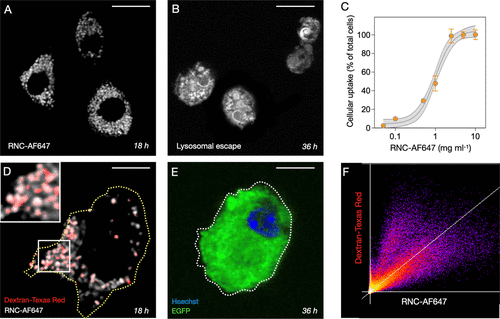
髓系细胞的摄取、溶酶体逃逸与蛋白表达
髓系细胞摄取实验显示,RNC能够克服传统LNP的溶酶体逃逸问题,显著提高转染效率。氟化修饰进一步促进了溶酶体逃逸,与不同溶酶体逃逸剂(氯喹等)的联合使用强化了性能。
体内性能
研究表明,RNC能高效递送mRNA至肿瘤微环境中的抗原呈递细胞,如树突状细胞和巨噬细胞。RNC展现了良好的药代动力学特性,其肿瘤特异性转染效率极为突出。
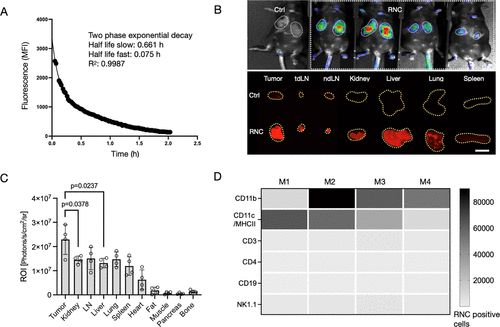
讨论
研究归因于RNC的优异性能:mRNA的高效凝聚、有效的糖基识别和溶酶体逃逸。相比传统LNP,RNC在递送效率和细胞特异性方面具有显著优势,为疫苗开发提供了新方向。
结论
RNC以其氟化修饰和多功能颗粒设计,实现了高效的髓系细胞mRNA递送和蛋白表达。该平台在疫苗开发、免疫治疗等领域展示了广阔的应用前景,未来研究将进一步扩展至肿瘤抗原刺激及多种癌症模型的应用。
参考文献
Kim, H. S.; Simpson, G. G.; Fei, F.; Garris, C.; Weissleder, R. Fluorinated Ribonucleocarbohydrate Nanoparticles Allow Ultraefficient mRNA Delivery and Protein Expression in Tumor-Associated Myeloid Cells. J. Am. Chem. Soc. 2025, jacs.4c14474. https://doi.org/10.1021/jacs.4c14474.