【Adv. Mater.】多年痛点终于解决,纳米药物在肿瘤中积累可以预测了!
简介
研究提出了一种新颖的非侵入性方法,通过标准医学影像(如 CT 和超声),结合放射组学模型,预测纳米药物在肿瘤中的积累。模型验证显示在小鼠肿瘤异种移植模型中,该方法有效预测了不同纳米粒子的积累水平。
摘要
纳米药物的肿瘤积累是精准医疗中患者分层和优化治疗策略的关键。研究提出了一种基于放射组学的非侵入性方法,利用常规医学影像,准确预测纳米药物在肿瘤中的积累。模型在小鼠肿瘤异种移植模型和不同尺寸的金纳米粒子上验证,预测肿瘤积累水平的 ROC 曲线下面积为 0.851。放射组学模型揭示了与致密基质相关的影像特征,这被认为是纳米药物递送的生物障碍。
研究结果与讨论
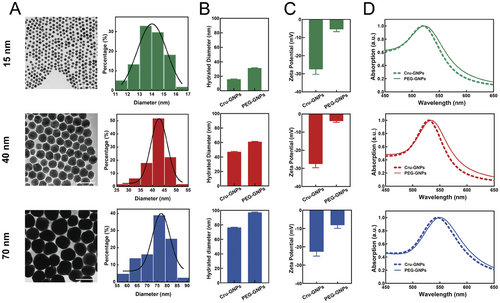
1. 金纳米粒子的表征:
研究合成了三种尺寸的金纳米粒子(15、40 和 70 nm),并通过透射电子显微镜和动态光散射进行表征。PEG 修饰后,粒子的水合直径增加,电荷趋于中性。
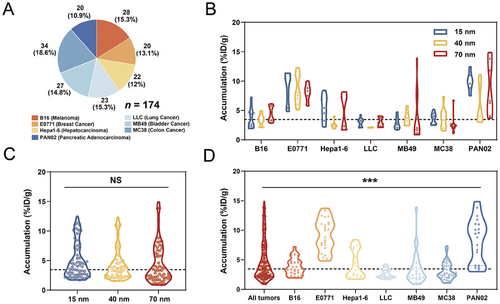
2. 肿瘤间金纳米粒子积累的变异性:
在小鼠模型中发现不同肿瘤细胞系间金纳米粒子的积累差异显著。不同粒子尺寸在肿瘤中的积累差异不显著,但不同细胞系间的积累水平差异显著。
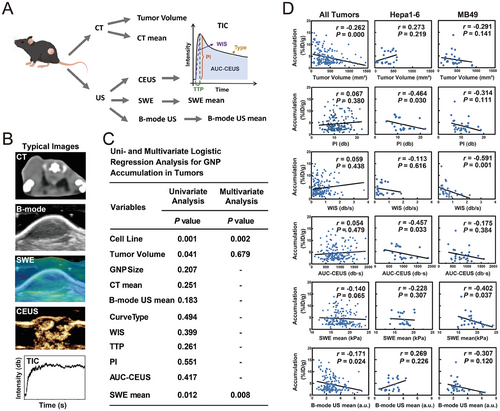
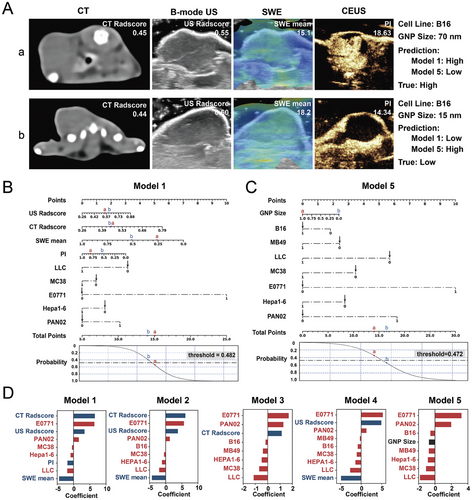
3. 影像特征与金纳米粒子积累的相关性:
通过 CT、B-mode 超声、剪切波弹性成像和对比增强超声进行肿瘤特征的手动提取。单变量和多变量逻辑回归分析显示,肿瘤体积、剪切波弹性成像均值和细胞系与金纳米粒子积累显著相关。
4. 放射组学模型的训练与验证:
放射组学模型从影像中高通量提取量化特征,并通过五种模型进行训练与验证。模型 1 在训练集和测试集中的 ROC 曲线下面积分别为 0.884 和 0.851,显著优于基线模型。
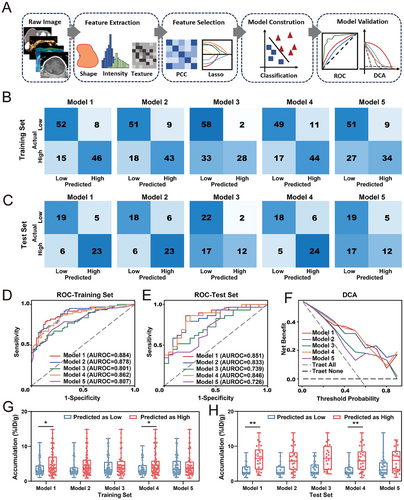
5. 模型解释:
放射组学模型能够识别与纳米药物递送障碍相关的生物学特征,如肿瘤的致密基质。验证发现剪切波弹性成像均值与胶原蛋白沉积面积显著相关,且胶原蛋白沉积与金纳米粒子积累负相关。
结论
本文展示了一种利用常规医学影像预测纳米药物肿瘤积累的放射组学模型,具有显著的预测性能。
参考文献
Tang, J.; Zhang, J.; Li, Y.; Hu, Y.; He, D.; Ni, H.; Zhang, J.; Wu, F.; Tang, Y.; Wang, S. Interpretable Radiomics Model Predicts Nanomedicine Tumor Accumulation Using Routine Medical Imaging. Advanced Materials 2025, 2416696. https://doi.org/10.1002/adma.202416696.