【JACS】突破性多阈值胶束技术提升STING免疫疗法精准抗癌效能
研究背景与创新点
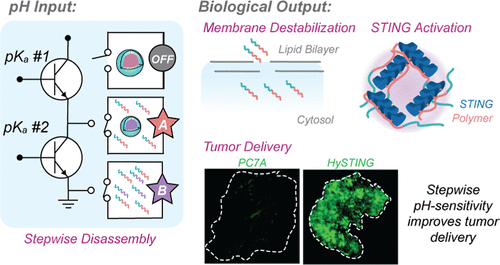
在癌症免疫治疗领域,STING(Stimulator of Interferon Genes,干扰素基因刺激因子)是一种关键的先天免疫蛋白,能够激活抗癌免疫反应。然而,传统的STING激活方式存在诸多药理学障碍,例如静脉给药后快速清除、低肿瘤累积率、膜通透性差等问题。为了解决这些问题,研究人员开发了一种创新型胶束递送策略,即混合STING激活胶束(HySTING),该胶束能够响应多阈值pH变化,提高肿瘤靶向能力,增强STING免疫治疗效果。
HySTING的设计与机理
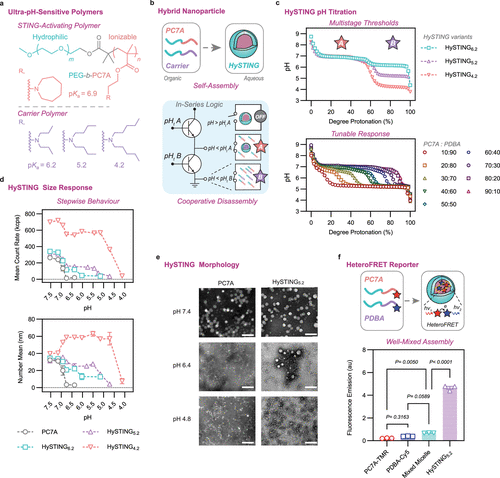
HySTING由两种聚合物构成:免疫刺激聚合物PEG-b-PC7A(pKa = 6.9)以及另一种具有较低pKa的载体聚合物。该设计赋予胶束逐级pH敏感性,使其在不同生理环境中保持稳定,同时能够在肿瘤微环境(pH较低)中特异性释放药物。HySTING的不同变体(HySTING 6.2、HySTING 5.2、HySTING 4.2)均形成单一胶束结构,但展现独立的离子化行为,确保PC7A的STING活性和膜破坏能力得以维持。
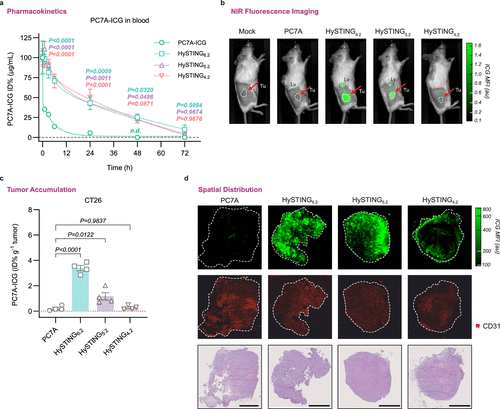
实验数据显示,HySTING的循环半衰期相较于PC7A的不足1小时大幅提升,其中HySTING 5.2的半衰期达到了18小时。这种药代动力学改善使得HySTING在肿瘤组织中的累积量提高了6至17倍。进一步的组织分布实验表明,与PC7A相比,HySTING在肿瘤中的积累显著增加,而在其他器官(如肝脏和脾脏)的分布相对相似,验证了其优越的肿瘤靶向性。
多阶段pH响应优化STING免疫激活
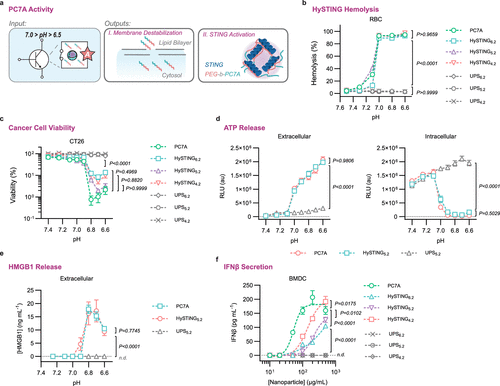
HySTING的核心优势在于其对pH变化的精准响应。在酸性环境(pH < 6.9)下,HySTING胶束会逐步解离,释放PC7A以激活STING。这一过程在红细胞溶血实验和CT26癌细胞培养实验中得到验证:当pH降至6.9时,HySTING胶束促使癌细胞发生死亡,并诱导ATP和HMGB1(高迁移率族蛋白1)释放,从而触发免疫反应。此外,在骨髓来源的树突状细胞实验中,HySTING显著诱导IFN-β分泌,进一步证明其STING活性。
优化CDN封装策略,提高抗肿瘤免疫效力
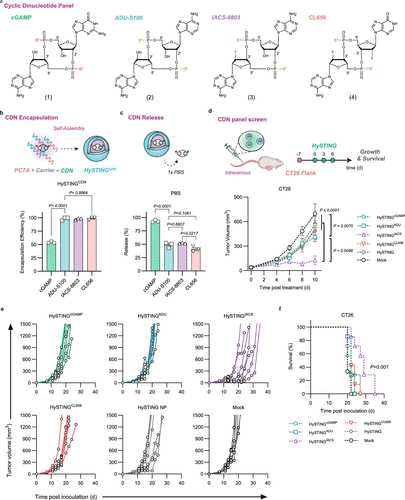
为了进一步提高STING激活效果,研究人员筛选了一组人工合成的环状二核苷酸(CDN),包括ADU-S100、IACS-8803和CL656。这些CDN在HySTING胶束中展现出更高的封装效率(超过97%),相比天然cGAMP(仅54%),其稳定性和释放控制能力明显增强。尤其是IACS-8803胶束,在CT26小鼠肿瘤模型中表现出最佳的抗肿瘤疗效,并在与抗PD-1抗体(免疫检查点抑制剂)联合使用时产生协同效应,显著提高存活率。
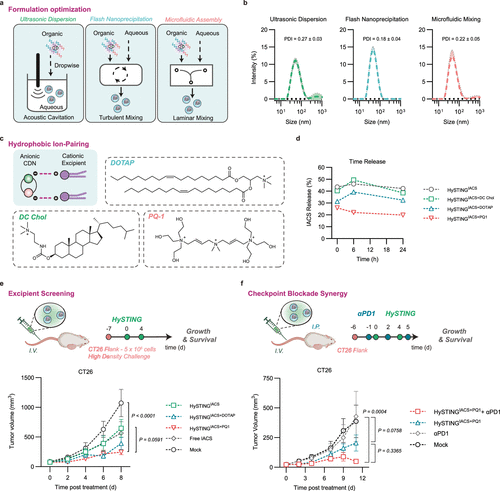
改进胶束制造工艺,提升药物稳定性
为了优化HySTING-IACS制剂,研究团队比较了不同的制造工艺(包括超声分散、纳米沉淀及微流控组装),发现纳米沉淀法能够生成更均匀的胶束结构。此外,为了降低药物在生理环境中的释放率,研究人员采用阳离子辅助技术,将IACS与阳离子化合物(如PQ-1和DOTAP)进行离子配对。这一策略最终实现了最佳的肿瘤抑制效果,尤其是在与抗PD-1联合使用时进一步提高了治疗效果。
结论与未来展望
HySTING胶束技术通过多阈值pH敏感性优化了STING免疫激活策略,并提升了肿瘤靶向性。在CT26肿瘤模型中,HySTING-IACS不仅增强了STING的免疫效应,还展现出优越的药代动力学特性。未来,该技术可能被应用于更广泛的癌症类型,尤其是难以渗透的实体瘤,为癌症免疫治疗带来新的可能性。
这项突破性研究极大地推动了癌症免疫治疗的发展,使HySTING成为精准抗癌治疗的有力工具。研究团队正进一步优化制剂,并探索临床应用前景,期待未来能够惠及更多患者。
参考文献
Bennett, Z. T.; Krishnamurthy, A.; Ye, S.; Basava, V. S.; Feng, Q.; Huang, G.; Sumer, B. D.; Gao, J. A Multi-Threshold Micelle Improves Tumor Accumulation and STING Immunotherapy. J. Am. Chem. Soc. 2025, jacs.4c17082. https://doi.org/10.1021/jacs.4c17082.