【Adv. Mater.】眼内滞留长达 70 天,显著的抗脉络膜新生血管效果,新型脂质修饰前药 SU 5402 助力黄斑变性
简介
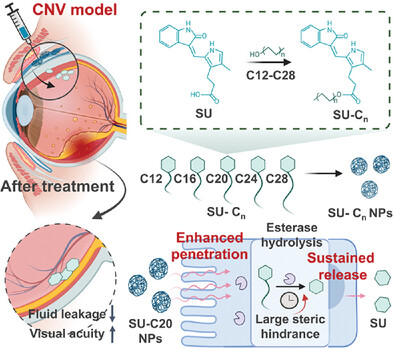
本文研究了一系列脂质修饰的前药(SU 5402,SU)及其纳米制剂在脉络膜新生血管(CNV)治疗中的应用,探索了不同链长脂质修饰对药物渗透性和滞留时间的影响,提出了以 C 20 为最佳修饰链长的前药策略。
摘要
脉络膜新生血管(CNV)是湿性年龄相关性黄斑变性(wAMD)的特征,现有的抗血管内皮生长因子(VEGF)疗法存在患者依从性差、治疗费用高和部分患者无效等问题。本文合成了不同链长的脂质修饰前药 SU 5402(SU),并制备了纳米制剂。通过比较各前药的释放速率、渗透性和滞留时间,发现 SU-C 20 纳米颗粒在小鼠眼内可滞留长达 70 天,具有显著的抗 CNV 效果。该研究为 CNV 治疗提供了新思路,特别是为 wAMD 患者提供了替代疗法。
研究结果与讨论
1. 前药纳米颗粒的制备与表征:
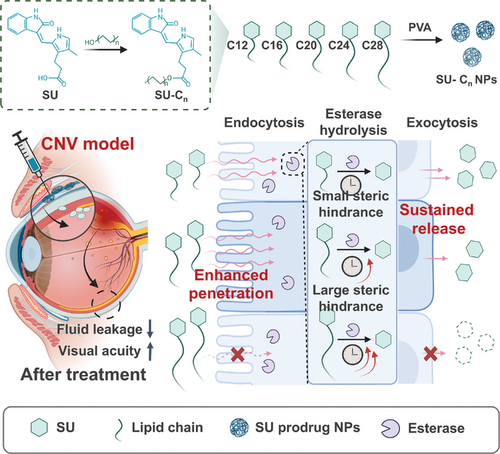
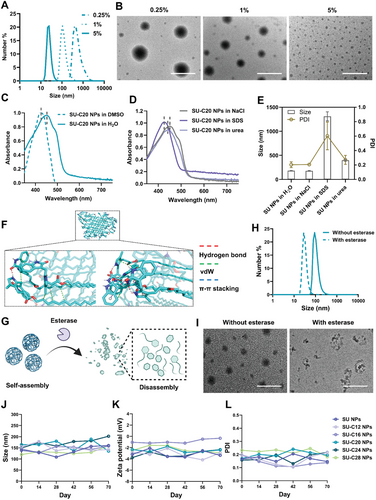
研究通过酯化反应将五种不同链长的脂质(C 12、C 16、C 20、C 24、C 28)修饰在 SU 分子上,生成 SU-C 12、SU-C 16、SU-C 20、SU-C 24、SU-C 28 前药。利用核磁共振(NMR)和傅立叶变换红外光谱(FTIR)确认了合成的成功。为提高前药的生物利用度,采用 1%聚乙烯醇(PVA)作为稳定剂制备纳米颗粒。动态光散射(DLS)分析表明,不同 PVA 浓度对颗粒大小有显著影响,最终选用 1% PVA 制备纳米颗粒,所有前药的包封效率超过 85%,载药量约为 40%。
2. 纳米颗粒的自组装机制:
研究以 SU-C 20 纳米颗粒为模型,探讨了其自组装机制。结果表明,SU-C 20 在水溶液中显示出显著的红移,表明存在π-共轭作用。进一步通过分子动力学模拟软件 GROMACS 验证,自组装过程主要由范德华力、氢键和π–π堆叠相互作用驱动。此外,脂质前药在酯酶作用下发生酯键水解,释放活性药物分子,保持纳米颗粒的稳定性长达 70 天。
3. 前药纳米颗粒的药物释放行为:
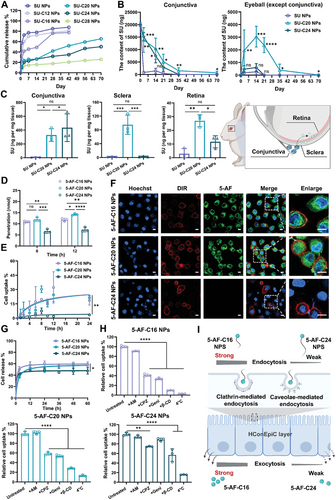
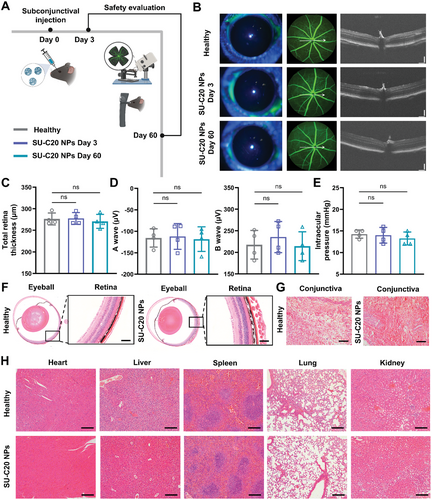
研究考察了不同链长前药纳米颗粒在 PBS 缓冲液中的释放行为。结果显示,长链脂质(C 20、C 24)的前药具有更低的突释和较慢的释放行为,其中 SU-C 20 和 SU-C 24 分别在 42 天时累计释放 52%和 34%。在小鼠模型中,SU-C 20 纳米颗粒在结膜下滞留时间最长,可达 70 天,并显著提高了眼内药物浓度。
4. 增强细胞渗透性的机制:
为了揭示碳链长度对眼部渗透性的影响,研究合成了 16、20 和 24 个碳原子的 5-氨基荧光素(5-AF)衍生物纳米颗粒。通过人结膜上皮细胞(HConEpiCs)单层渗透性实验、细胞内吞和外排实验,发现较短链长的 5-AF-C 16 和 5-AF-C 20 纳米颗粒具有更高的细胞内吞水平和渗透性。研究还表明,纳米颗粒主要通过依赖动力蛋白的吞噬途径和小窝介导的内吞途径进入细胞。
5. 体外抗血管生成效果:
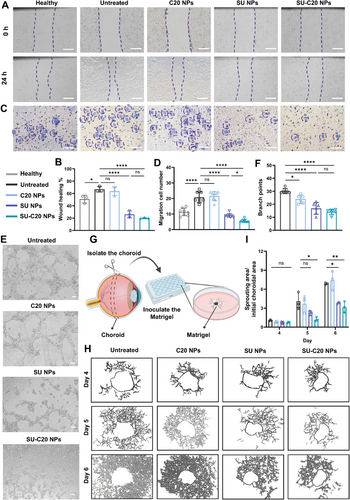
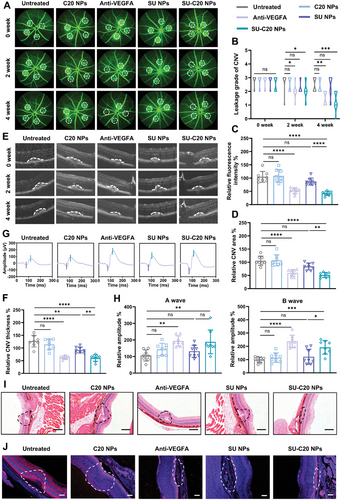
在体外研究中,SU-C 20 纳米颗粒表现出优异的抗血管生成效果。在划痕实验和 Transwell 迁移实验中,SU-C 20 显著抑制了人脐静脉内皮细胞(HUVECs)的迁移。在 Matrigel 管形成实验中,SU-C 20 抑制了血管网络的形成。在 CNV 小鼠模型中,SU-C 20 纳米颗粒显著减少了荧光素泄漏面积和 CNV 病变厚度,表现出优异的抗 CNV 效果。
结论
本文通过调控硫氧连接剂的聚集状态,开发了一系列新型 NIR-II 荧光染料,展示了显著的 pH 响应行为和光声强度增强。
参考文献
Lv, X.; Shen, J.; Du, X.; Yue, B.; Zhang, Q.; Chang, W.; Miao, Y.; Ji, Z.; Chen, L.; Gong, Y.; Yang, Y.; Chen, Q. The Optimized Lipid‐Modified Prodrug for CNV Treatment. Advanced Materials 2025, 2419263. https://doi.org/10.1002/adma.202419263.