【Adv.Mater.】83%共定位!新型纳米诱导剂精准触发II型免疫细胞死亡,推进癌症热疗革命
研究背景与意义
癌症免疫治疗是当前肿瘤治疗的重要方向,尤其是针对“冷”肿瘤,免疫细胞浸润不足导致治疗效果不佳。免疫原性细胞死亡(ICD)是一种能够将死亡的肿瘤细胞转化为治疗性癌症疫苗的策略,其中内质网(ER)应激在诱导ICD方面发挥关键作用。然而,传统的ICD诱导剂缺乏精准的ER靶向策略,使得选择性诱发II型ICD仍面临挑战。
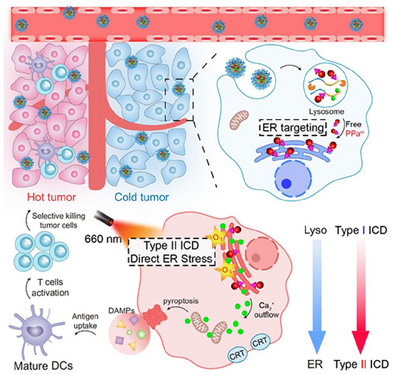
为解决这一难题,本研究团队开发了一种pH/猫酶B激活纳米平台(PCAN),该平台能够精确光诱导ER应激,并专门触发II型ICD,从而增强癌症免疫治疗效果。该策略不仅优化了ICD诱导过程,还增强了肿瘤微环境的免疫激活效果,为癌症热疗提供了新的思路。
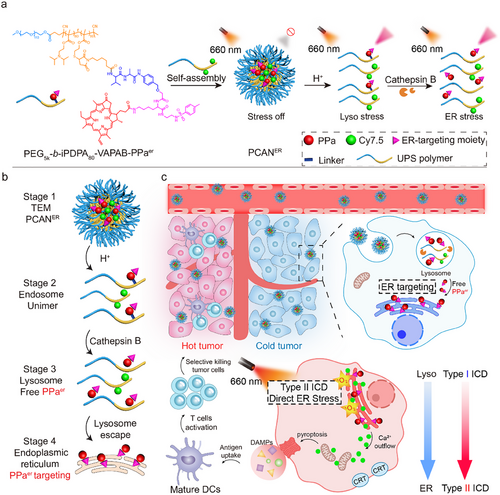
PCAN的结构与功能
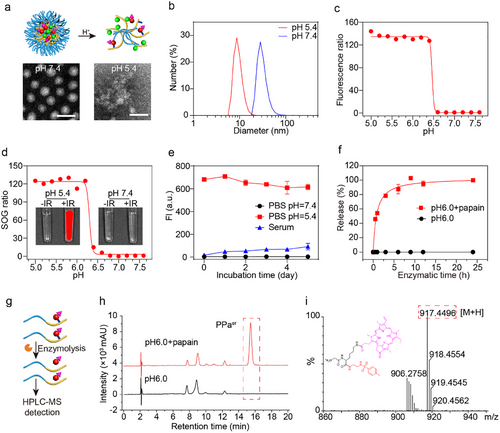
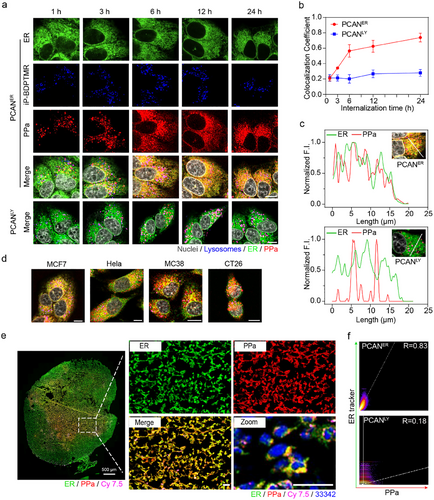
PCAN采用长循环纳米药物设计,结合pH/猫酶B双重门控机制,在癌组织内实现高效ER靶向。实验数据显示,PCAN在癌细胞中的ER共定位效率高达83%,确保其精准作用于ER,提高II型ICD的诱导效果。
当PCAN进入癌组织后,纳米药物通过细胞吞噬作用进入内涵体,并在酸性环境中发生解体,随后在猫酶B作用下裂解,释放ER靶向光敏剂(PPaer)。这种时空调控策略使PPaer能够从溶酶体逐步传输至ER,实现精准的亚细胞器靶向。
在光照(660nm激光)作用下,PCAN在ER内部生成大量活性氧(ROS),触发葡萄糖调节蛋白78(GRP78)与钙网蛋白(CRT)的暴露,进而放大II型ICD效应,并诱导焦亡(pyroptosis),有效增强肿瘤免疫激活能力。
II型ICD的免疫增强机制
实验研究发现,与仅触发溶酶体应激的PCANLy相比,PCANER显著提高ICD诱导能力:
- GRP78显著上调:作为ER应激关键调节蛋白,其高表达促进ER应激介导的免疫激活。
- CRT向细胞膜迁移:作为“吞噬信号”,CRT暴露增强抗原呈递细胞的识别能力。
- ATP和HMGB1释放:ATP作为免疫增强因子,而HMGB1的外排进一步促进免疫细胞浸润。
- 骨髓来源树突细胞(BMDCs)的成熟度提高:在肿瘤微环境中,BMDCs的CD80+ CD86+表达比例提升至68.8%,比PCANLy诱导的水平高出3.6倍,表明其能够有效激活树突细胞,促进肿瘤免疫循环。
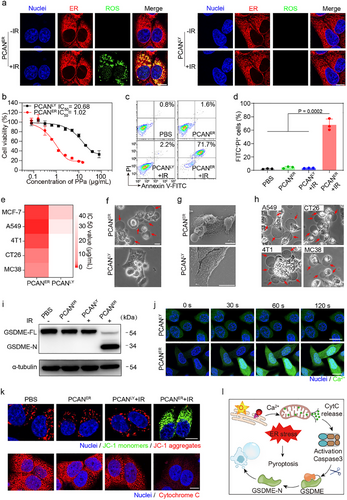
此外,PCANER触发的焦亡途径进一步促进T细胞浸润,提高肿瘤微环境的免疫活性,形成正反馈机制,增强PD-1免疫治疗效果。
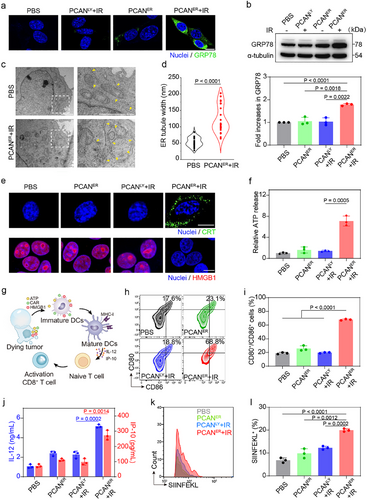
体内抗肿瘤效果
在小鼠CT26-OVA肿瘤模型中,PCANER的抗肿瘤免疫作用显著:
- 肿瘤组织中T细胞浸润率提高
- 肿瘤体积显著缩小
- 免疫细胞活化增强
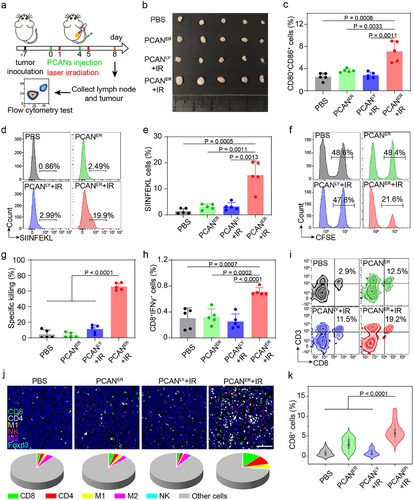
同时,PCANER的快速肾脏清除机制确保其在体内的安全性,减少光毒性风险。
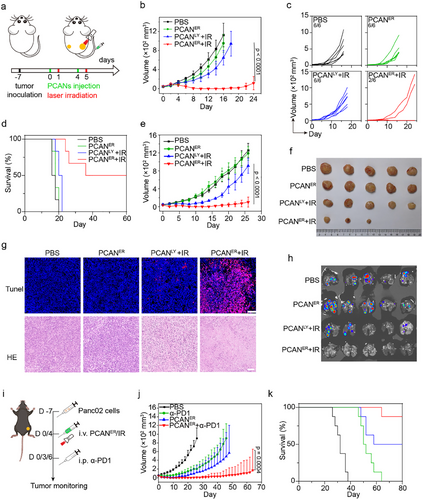
研究意义与未来展望
本研究通过纳米医学与免疫治疗的结合,构建了一种高效的ER靶向策略,实现了II型ICD的精准调控,为癌症热疗和免疫治疗提供了新的方法。这一突破性技术不仅优化了免疫原性细胞死亡的诱导过程,还为“冷”肿瘤的治疗提供了新思路,有望推动个性化癌症免疫治疗的临床应用。
未来,该策略可进一步结合CAR-T、肿瘤疫苗等免疫疗法,提高整体治疗效果,展现出广阔的临床转化潜力!
参考文献
Zhang, Y.; Yan, Y.; Liu, J.; Xia, H.; Zhou, J.; Cui, Y.; Huang, X.; Chang, J.; Zhang, W.; Chen, W.; Zhang, Q.; Wang, S.; Wang, Y.; Chen, B. An Endoplasmic Reticulum Stress‐Specific Nanoinducer Selectively Evokes Type‐II Immunogenic Cell Death for Pyroptotic Cancer Immunotherapy. Advanced Materials 2025, e2501953. https://doi.org/10.1002/adma.202501953.