【Angew.Chem.】三重靶向放射增敏剂,增强缺氧肿瘤靶向和放射免疫治疗效果,有效抑制了肿瘤生长和转移
简介
本文介绍了一种新型三重靶向放射增敏剂A-Cy-Ni-RGD NPs,通过近红外荧光和光声双模成像引导的放射免疫治疗,显著提高了缺氧肿瘤的治疗效果。
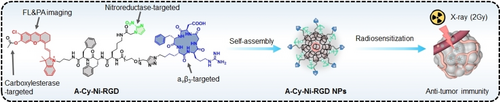
摘要
放射治疗中,缺氧肿瘤区域由于氧气不足导致的放射抗性大大削弱了治疗效果。为了解决这一难题,本文提出了一种新型三重靶向放射增敏剂A-Cy-Ni-RGD NPs。这种纳米颗粒能够自组装并靶向肿瘤,通过近红外荧光和光声双模成像监测肿瘤缺氧水平,指导低剂量X射线照射(2Gy)。在小鼠乳腺癌模型中,A-Cy-Ni-RGD NPs显著提高了放射治疗和免疫治疗的效果,有效抑制了肿瘤生长和转移,延长了小鼠的生存期。
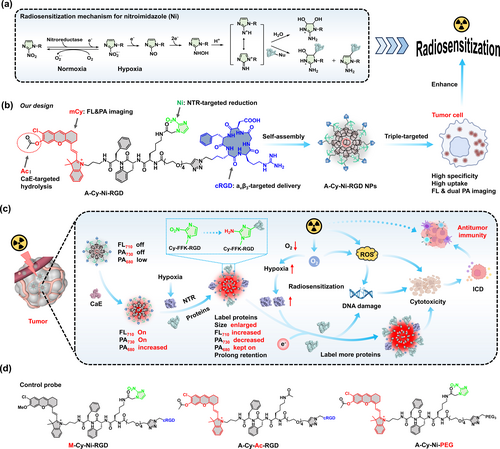
研究结果与讨论
纳米颗粒的自组装和表征
A-Cy-Ni-RGD在生理条件下能自组装成均一分散的纳米颗粒(直径约50nm),并且在溶液中稳定存在。
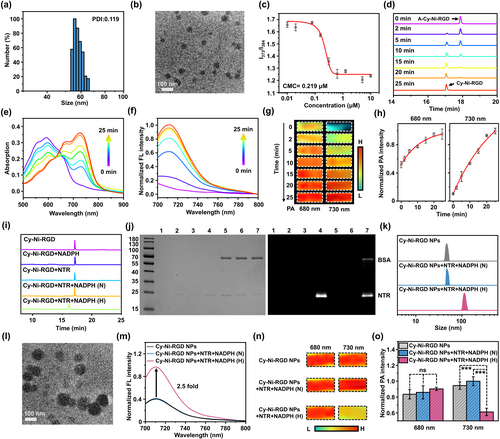
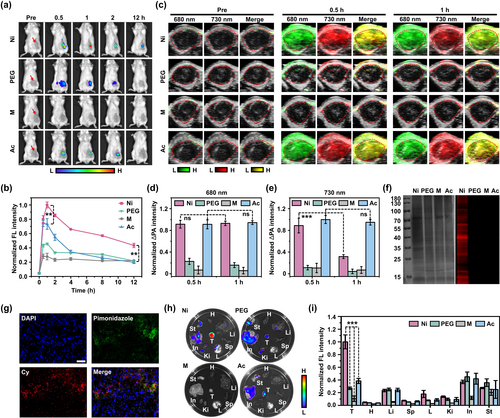
细胞内活化和成像
在肿瘤细胞内,A-Cy-Ni-RGD NPs能够被内源性酯酶激活,生成Cy-Ni-RGD NPs,增强近红外荧光和光声信号。在缺氧条件下,这些纳米颗粒进一步被还原酶还原,与内源性蛋白质共价标记,增加了纳米颗粒的尺寸和荧光信号强度。
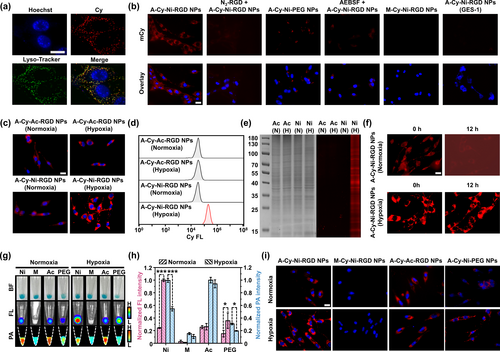
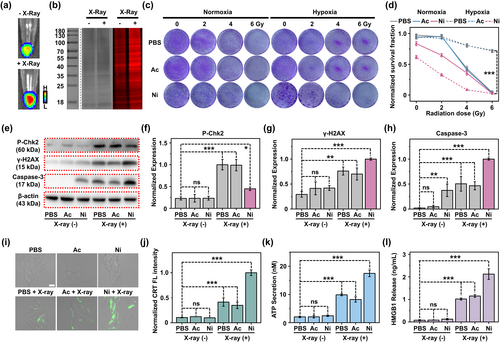
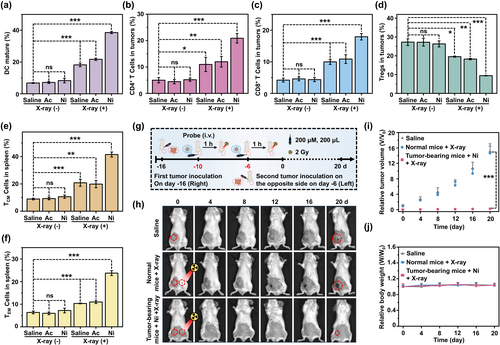
放射增敏和免疫治疗
A-Cy-Ni-RGD NPs在低剂量X射线照射下,显著增强了肿瘤细胞的DNA损伤,诱导了强烈的免疫细胞死亡反应。在小鼠模型中,这种放射增敏剂显著抑制了肿瘤的生长和转移,显著延长了小鼠的生存期。
结论
本文研究表明,A-Cy-Ni-RGD NPs作为一种新型三重靶向放射增敏剂,通过自组装、成像和放射免疫治疗,显著提高了缺氧肿瘤的治疗效果。这一工作为缺氧肿瘤的放射治疗提供了一种新策略,具有重要的临床应用潜力。
参考文献
Tian, Y.; Wang, L.; Chen, R.; Miao, Y.; Liu, Y.; Huang, W.; Fang, L.; Liu, S.; Luo, J.; Sun, X.; Zhang, Y.; Ye, D. Self‐Assembled Triple‐Targeted Radiosensitizer Enhances Hypoxic Tumor Targeting and Radio‐Immunotherapy Efficacy. Angew Chem Int Ed 2025, e202500645. https://doi.org/10.1002/anie.202500645.