【JACS】如何让癌症无处可逃?——突破性共价靶向亲和蛋白药物助力精准治疗
研究背景
亲和蛋白(如 affibody 和 monobody)是一类小型支架蛋白,具有极强的肿瘤靶向能力。然而,由于其分子小,临床应用面临血液快速清除和肿瘤滞留不足的问题。传统的亲和蛋白药物通常只能通过可逆作用结合靶点,而其在肿瘤组织中的滞留时间有限,降低了治疗效果。为了克服这一难题,本研究提出了一种新的共价靶向策略,使亲和蛋白能够与其靶点形成不可逆的结合,从而显著提高肿瘤滞留并提升治疗效果。
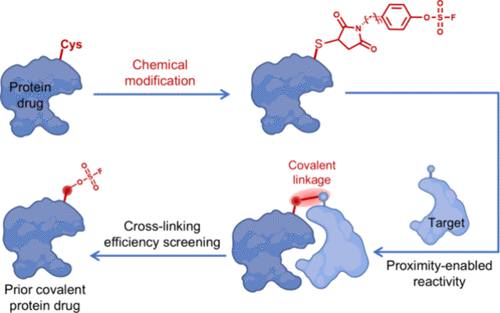
共价靶向策略
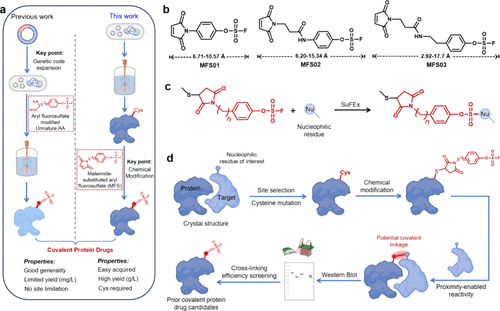
研究团队采用 SuFEx(硫氟交换)化学,开发了一种 maleimide 取代芳基氟硫酸酯(MFS) 连接子,使亲和蛋白能够通过化学修饰与靶点共价结合。关键步骤包括:
- 设计 MFS 连接子:该连接子通过 thiol 反应与蛋白上的半胱氨酸位点相连,使蛋白具备与靶点共价结合的能力。
- 筛选适合的连接子长度:研究人员合成了不同长度的 MFS 连接子,以确定最佳结合效果。
- 共价交联实验:通过蛋白免疫印迹(Western blot)验证修饰的亲和蛋白是否能够与靶点形成稳定的共价连接。
研究结果
体外实验
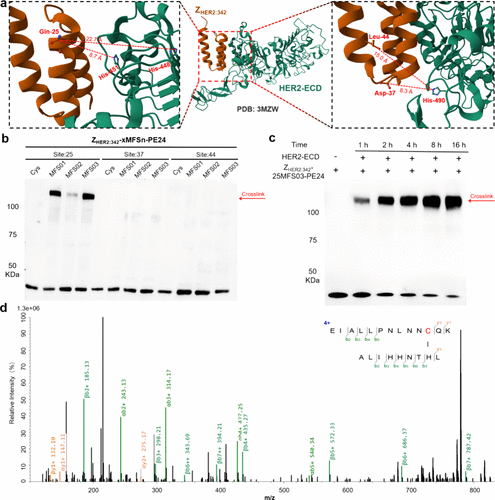
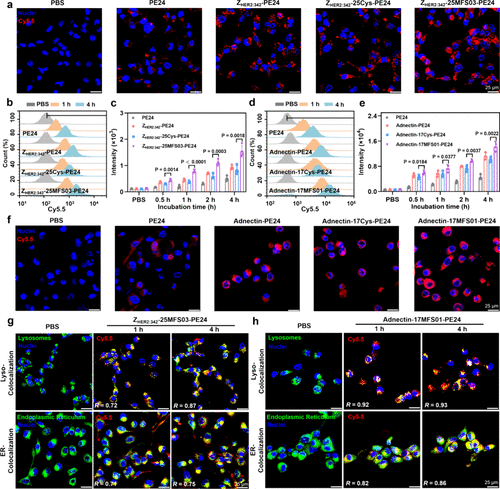
- 亲和蛋白对 HER2 的结合效率:
- 采用 MFS 修饰的 affibody 亲和蛋白在体外实验中对 HER2 受体的共价结合率达到了 72%,远高于非共价对照组。
- 细胞摄取实验显示,共价修饰的 affibody 蛋白较非共价药物提高了 185% 细胞摄取率,证明其共价结合能力可以增强肿瘤细胞对药物的摄取。
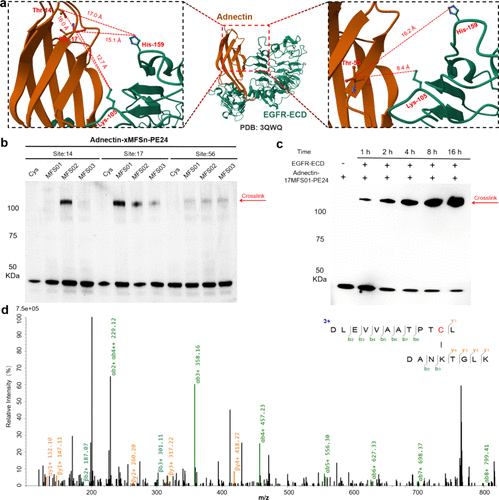
- 亲和蛋白对 EGFR 的结合效率:
- 研究团队还针对 EGFR 受体 开发了 monobody 亲和蛋白,实验结果显示其与 EGFR 形成了稳定的共价结合,提高了药物在肿瘤组织中的滞留效果。
- 经过优化的 Adnectin-17MFS01-PE24 亲和蛋白能够与 Lys105 位点共价交联,确保药物在癌细胞中的持久作用。
细胞摄取及内化机制
- 共价修饰显著提高了亲和蛋白的 细胞摄取能力,荧光标记实验显示:
- HER2 靶向的 affibody 亲和蛋白 在 SKOV-3 细胞中的摄取比非共价修饰药物 提升 1.85 倍。
- EGFR 靶向的 monobody 亲和蛋白 在 A-431 细胞中的摄取比非共价修饰药物 提升 1.39 倍。
- 共价修饰蛋白主要通过 受体介导的内吞 进入细胞,并在 溶酶体环境 中释放活性成分。
体内实验
- 在小鼠模型中,共价亲和蛋白药物的 肿瘤滞留能力较非共价药物提高 2.01 倍,有效延长药物在肿瘤组织中的作用时间。
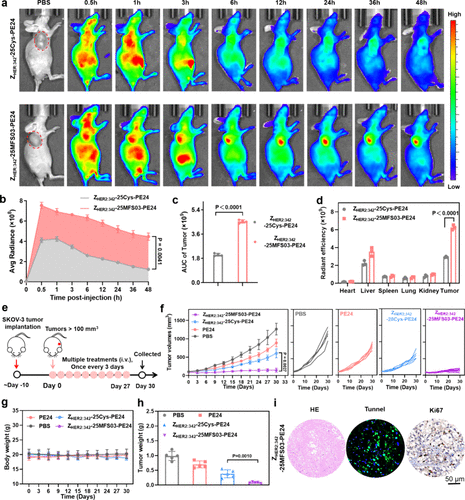
- 通过活体荧光成像观察药物在小鼠体内的分布,显示 共价修饰蛋白药物能够更快、更稳定地富集于肿瘤组织,降低在正常器官的分布,提高靶向治疗效果。
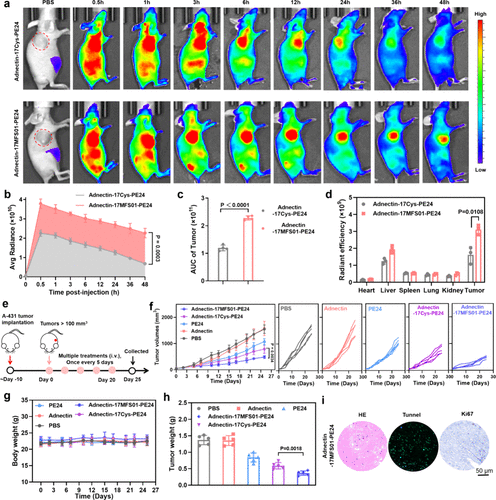
- 经过 16 小时的实验,72.08% 以上的药物成功共价结合靶点,大幅减少药物流失,提高治疗效果。
抗肿瘤疗效
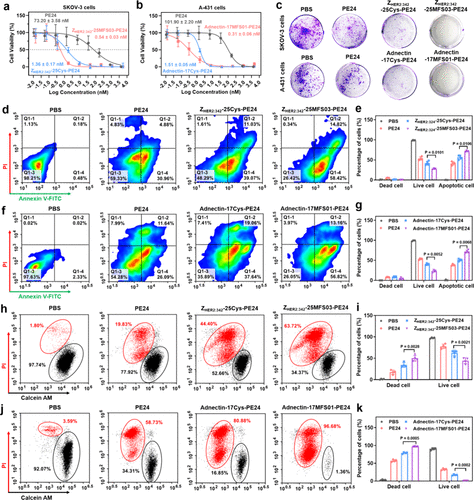
细胞存活率测定(CCK-8):
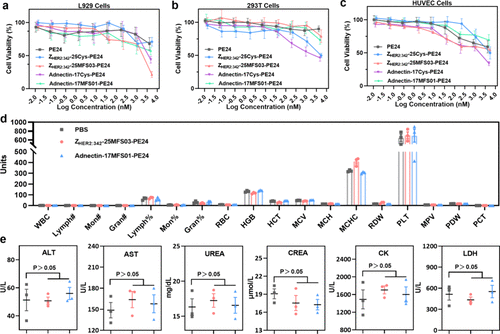
- 研究发现,采用共价修饰的 affibody 亲和蛋白药物 ZHER2:342-25MFS03-PE24 对 SKOV-3 细胞的半数抑制浓度(IC50)仅为 0.54 nM,相比非共价对照组 下降了 2.5 倍。
- 类似的,采用共价修饰的 monobody 亲和蛋白药物 Adnectin-17MFS01-PE24 对 A-431 细胞的 IC50 仅为 0.31 nM,相比非共价药物 下降了 4.9 倍。
细胞凋亡实验:
- 荧光标记实验显示,服用共价修饰药物的癌细胞 凋亡率达到 73.58%(HER2 靶向),相比未修饰药物 提升 27%。
- 另一组实验发现 EGFR 靶向药物的凋亡率达到 73.95%,相比未修饰的药物 提升 41%。
动物实验:肿瘤抑制效果:
- 在小鼠模型中,共价亲和蛋白药物的 肿瘤抑制效果显著提高,接近完全抑制肿瘤生长。
- 观察发现,共价修饰蛋白药物在肿瘤组织中保持 高浓度分布超过 48 小时,相比非共价药物的分布时间(24 小时) 延长了一倍。
结论
本研究开发了一种新型的 化学修饰策略,通过 SuFEx 反应 在亲和蛋白药物上引入共价结合能力,显著增强其肿瘤滞留能力,提高治疗效率。实验结果表明:
- 亲和蛋白的共价结合能力增强了药物摄取,提高了 药物浓度 和 肿瘤滞留时间。
- 共价靶向策略提高了肿瘤细胞的凋亡率,优化了治疗效果,使肿瘤几乎完全消失。
- 该策略可广泛应用于其他蛋白药物,为未来的生物制药提供新的可能性。
这一策略为亲和蛋白类癌症治疗药物的开发提供了强有力的支持,有望大幅提高癌症靶向疗法的效率,同时推动蛋白类药物的临床应用。
参考文献
Xia, X.; Gao, W.; Yang, X.; Huang, W.; Xia, X.-X.; Yan, D. Chemically Engineered Affinity Protein Drugs for Covalent Targeted Cancer Therapy. J. Am. Chem. Soc. 2025, jacs.5c02212. https://doi.org/10.1021/jacs.5c02212.