【Biomaterial】NIR-II成像引导的可变尺寸纳米系统增强深层肿瘤声动力治疗
简介
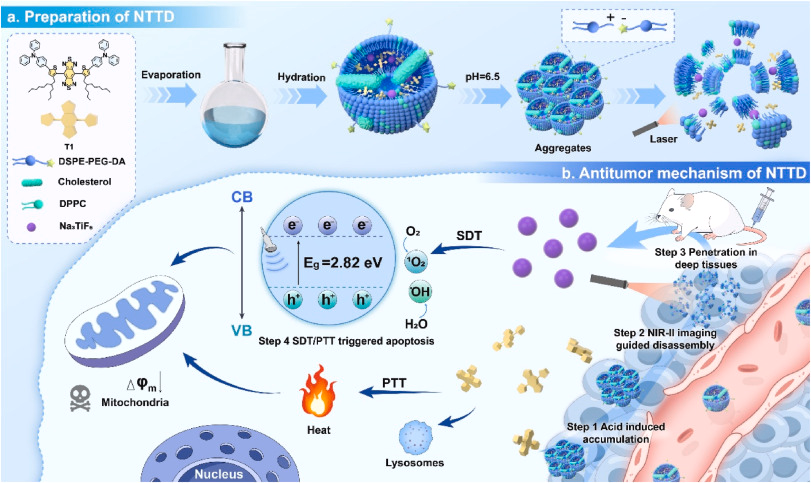
声动力治疗(SDT)是一种利用超声激活肿瘤部位声敏剂产生活性氧(ROS)的非侵入性治疗方式。然而,传统声敏剂在肿瘤部位的富集和渗透不足,影响治疗效果。本研究开发了一种肿瘤酸性和光热响应控制的纳米系统(NTTD),联合新型声敏剂Na₃TiF₆纳米颗粒(NPs)和第二近红外区(NIR-II)荧光团(AIEgen-T1),实现高效SDT/光热治疗(PTT)。
摘要
本文介绍了一种创新的肿瘤治疗策略,通过设计NTTD纳米系统,实现深层肿瘤高效SDT/PTT。NTTD包含超小Na₃TiF₆ NPs,具备增氧空位、窄带隙(2.82 eV)及优异的水和氧气吸收能力,在超声刺激下能强效生成ROS。同时,NTTD利用酸性/光热响应及深度NIR-II荧光成像(可达7 mm),通过两步尺寸转变,提高肿瘤部位的富集与渗透。在4T1肿瘤模型中,NTTD延长肿瘤滞留时间至60小时,成像信号增强约2.4倍,光照辅助下的渗透能力提高约4.5倍。SDT/PTT协同作用诱导显著ROS生成,肿瘤抑制率达75.2%。本研究提出了一种精准提高声敏剂肿瘤积累与渗透的创新策略,为临床应用提供可能。
研究结果与讨论
Na₃TiF₆ NPs的合成与表征
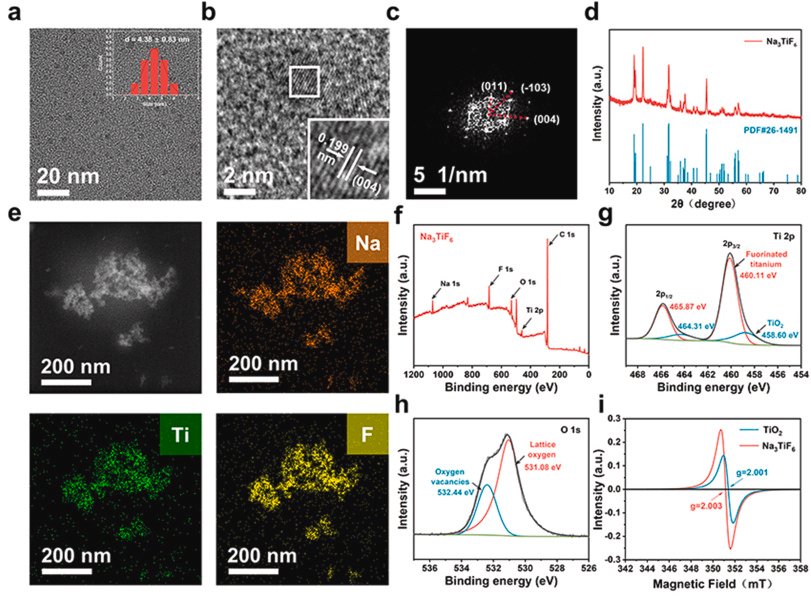
Na₃TiF₆ NPs采用有机相策略合成,TEM图像显示其单分散球形形态,平均尺寸4.38 nm,选区电子衍射(SAED)及X射线衍射(XRD)证实晶体纯度,元素映射证明其成功合成。
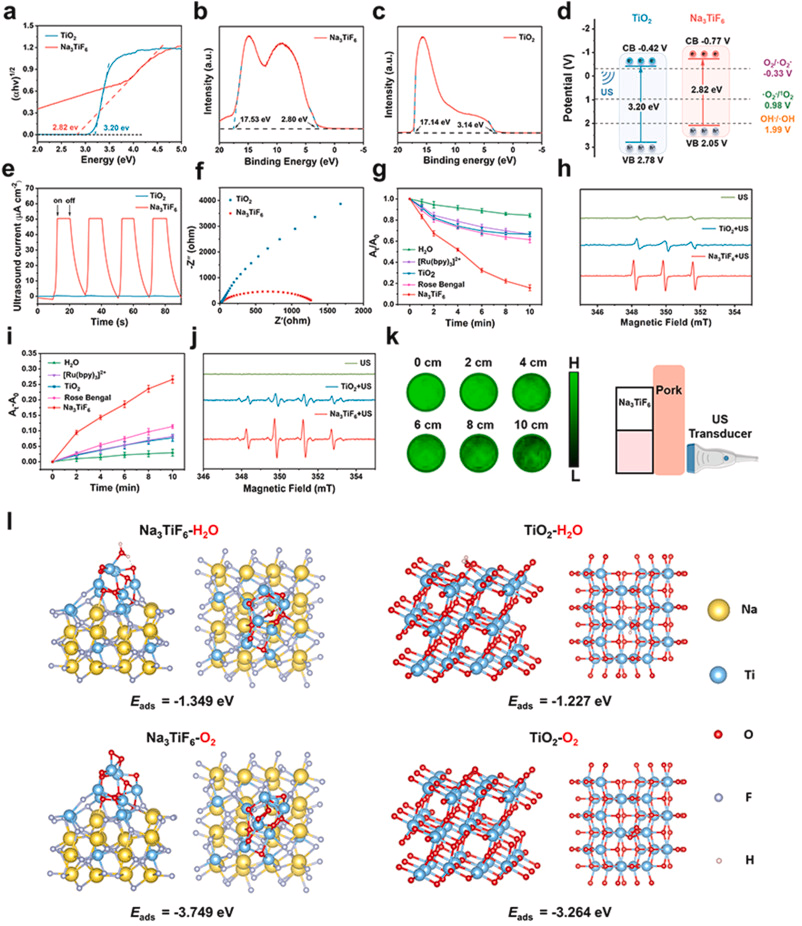
Na₃TiF₆ NPs的声动力性能
通过Tauc图计算Na₃TiF₆ NPs的带隙为2.82 eV,较传统TiO₂(3.2 eV)更窄,有利于电子-空穴分离,提高超声催化效率。超声电流测试表明Na₃TiF₆ NPs的超声触发电流(50 μA/cm²)远高于TiO₂(0.2 μA/cm²),电化学阻抗分析显示其电荷转移阻抗较小,说明其良好分离特性。DPBF降解实验表明其生成ROS能力较商业声敏剂更强,ESR测试证实其有效生成单线态氧(¹O₂)和羟基自由基(•OH)。
NTTD的合成与表征
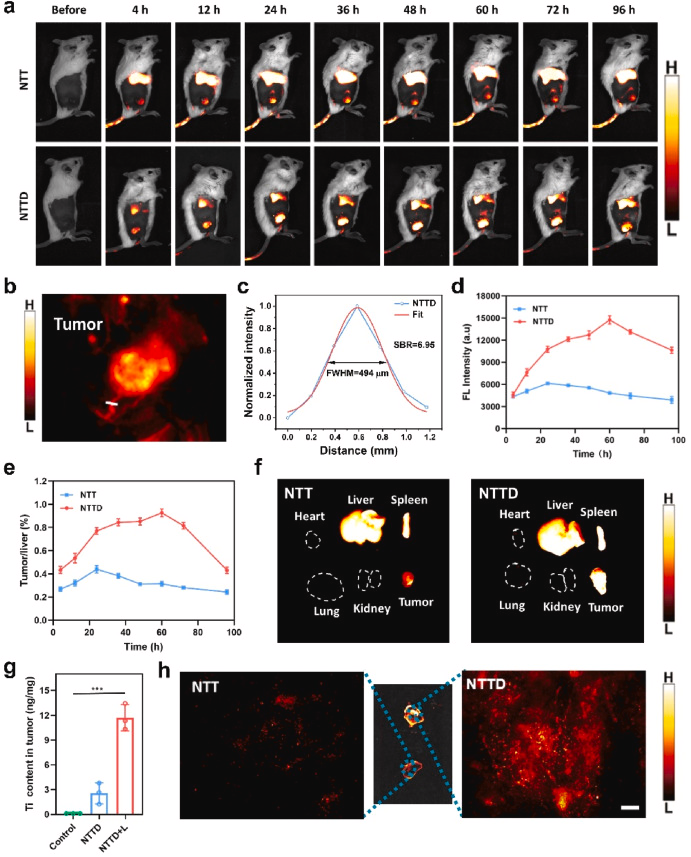
NTTD采用薄膜分散法合成,包含pH和光热双响应脂质体,TEM图像显示其平均尺寸147 nm,XRD证实Na₃TiF₆ NPs的存在,元素映射确认T1和声敏剂的有效封装。NTTD具有优异NIR-II荧光性能,最大发射波长1000 nm,成像穿透深度可达7 mm,显示出优异的光稳定性和生物稳定性。
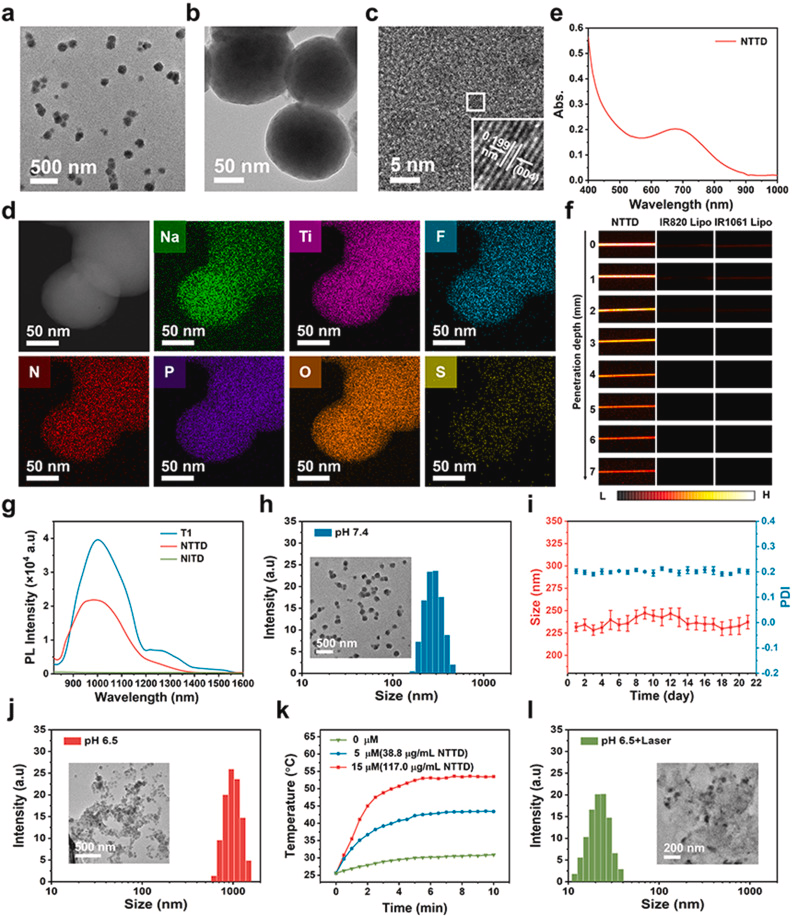
NTTD的多阶段尺寸转变
NTTD在pH 6.5环境下自组装成1106 nm大聚集体,随后在808 nm光照诱导下解离为21 nm小颗粒,提高肿瘤渗透力。这种酸响应及光热驱动的双重控制策略在肿瘤治疗中具有重要应用前景。
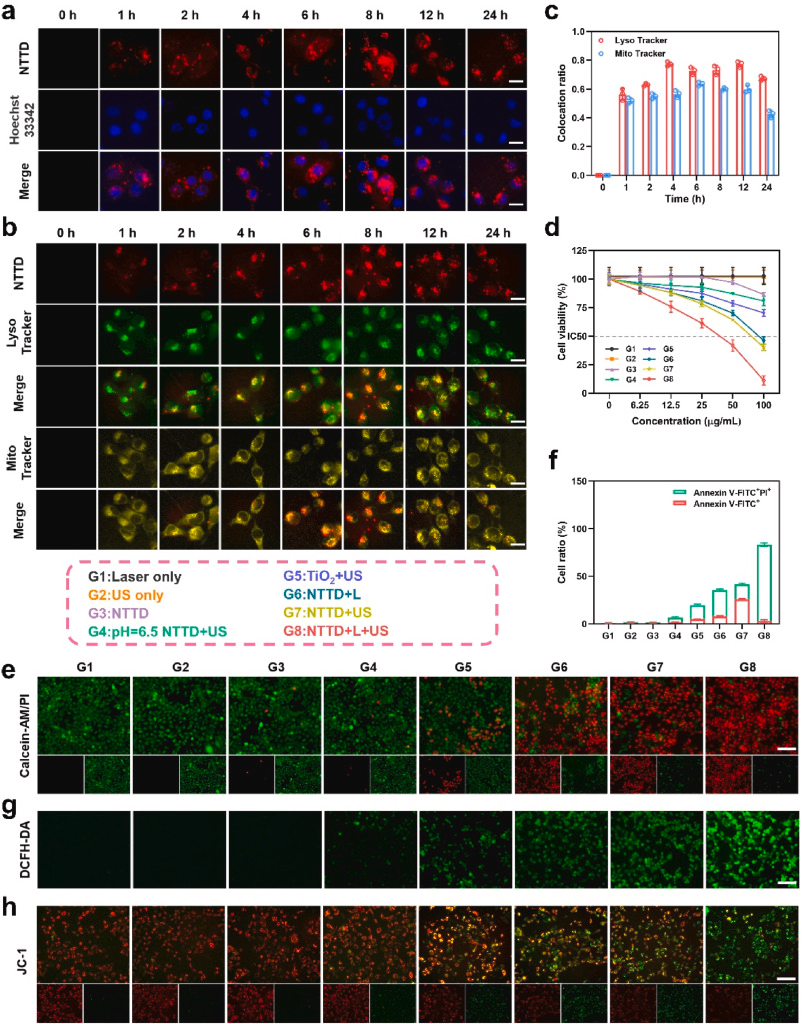
NTTD的细胞摄取与抗肿瘤性能
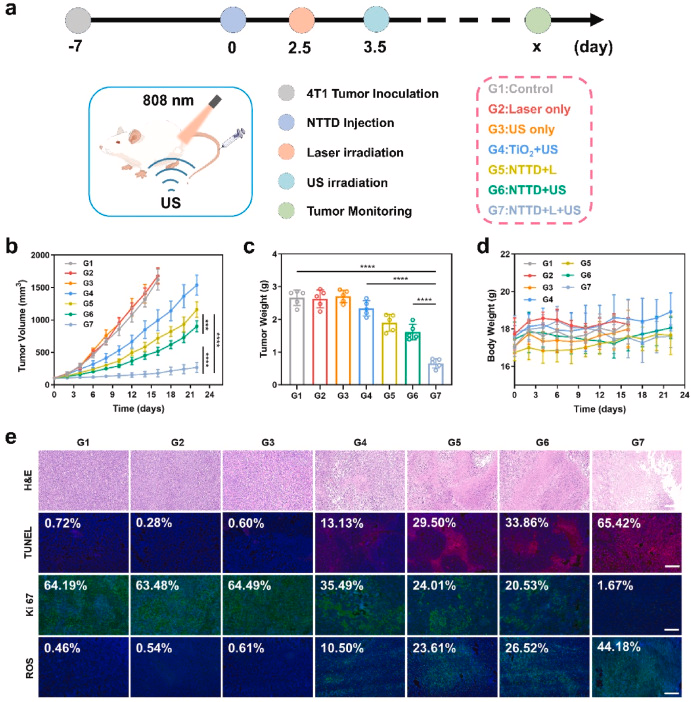
NTTD在4T1细胞中的摄取呈时间依赖性增强,并主要定位于溶酶体。细胞存活率测试显示,NTTD + 激光 + 超声组的肿瘤细胞存活率最低(33.2 μg/mL)。联合治疗组诱导细胞凋亡率达到81.89%,显著高于单独超声或光照治疗组,展示出更优的抗肿瘤效果。
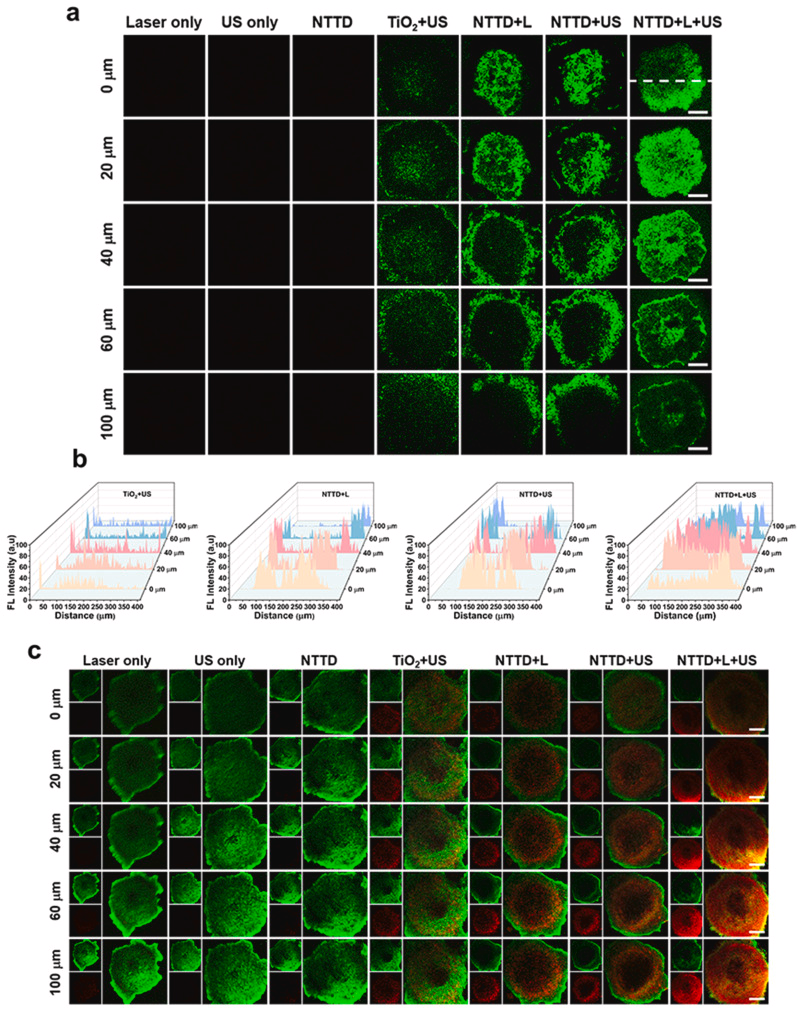
结论
本研究提出了一种新型NTTD纳米系统,通过NIR-II荧光成像指导的尺寸变化,提高肿瘤部位的声敏剂富集与渗透,增强SDT/PTT治疗效果。在体内实验中,NTTD展现出长滞留时间、高成像信号增强及有效抗肿瘤能力,为肿瘤治疗提供了新思路。