【JACS】精准纳米图案化:紫外交联DNA纳米材料助力叶酸受体靶向递送
本文讨论了一项创新性研究,研究团队成功利用紫外(UV)交联技术,打造高度稳定的DNA纳米材料,以优化叶酸受体介导的细胞摄取。这项工作不仅提高了纳米材料的结构完整性,还为精准药物递送开辟了新的方向。以下是研究的主要内容和贡献:
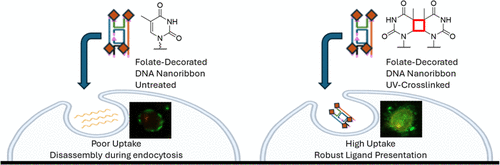
背景与研究动机
在纳米医学领域,药物和生物分子递送经常依赖纳米材料作为载体。然而,传统的纳米材料在细胞摄取过程中通常缺乏对配体密度和空间排列的精确控制,导致递送效率受到限制。叶酸受体(FRα)是一种在多种癌细胞表面过度表达的靶点,叶酸配体的有效图案化对于提升细胞靶向性至关重要。
DNA纳米材料的设计与紫外交联
研究团队构建了具有精确叶酸配体分布的DNA纳米材料,并通过UV照射促进胸腺嘧啶交联,使结构更加稳定:
- 双交叉(DX)DNA瓦片:该纳米材料采用双交叉DX结构,保证刚性与结构完整性。
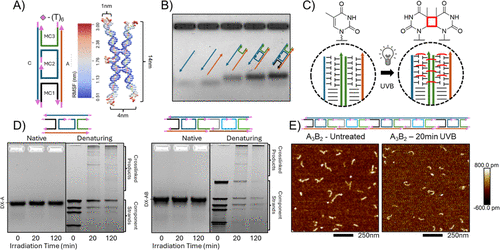
- 紫外交联技术:研究团队通过UV-B照射,使胸腺嘧啶发生二聚化反应,从而将DNA结构固定。实验表明,在20分钟UV照射后,DNA纳米材料实现了高效交联,显著提升了耐受核酸酶降解的能力。
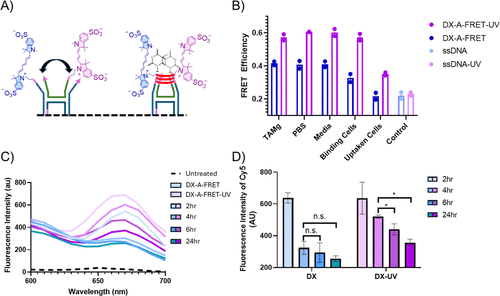
增强细胞摄取与内部动力学分析
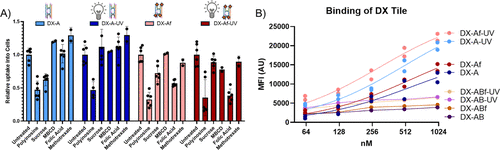
研究团队利用流式细胞术与荧光能量转移(FRET)技术,分析DNA纳米材料在HeLa细胞中的摄取机制:
- 交联增强摄取:UV交联的DX结构在进入细胞时保持完整性,表现出比未交联结构更高的摄取效率。
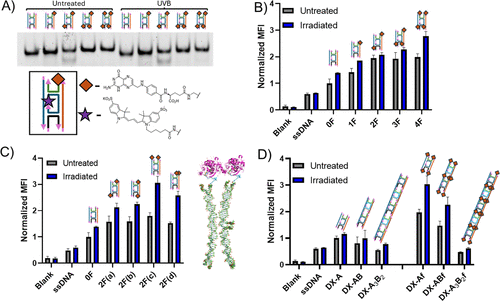
- 叶酸配体优化:研究发现,两个叶酸分子以约5.2纳米间距排列时,摄取效率最高;而过度密集排列可能引发受体间的空间位阻效应。
- UV交联改变摄取途径:实验发现,未经交联的DNA纳米材料依赖网格蛋白介导的内吞作用,而交联后的DNA结构则避免了这一途径,促进更高效的摄取。
基因沉默应用:精准靶向癌细胞
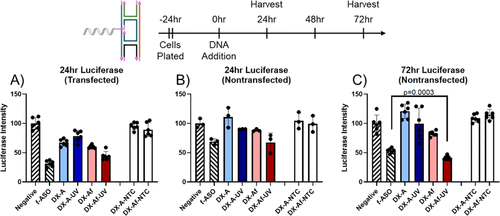
研究团队进一步将这些纳米材料用作基因沉默载体,以调控癌细胞中的基因表达:
- 靶向性提高:研究发现,UV交联后的DNA纳米材料可以准确递送基因沉默寡核苷酸至FRα阳性癌细胞,而未修饰结构难以实现高效递送。
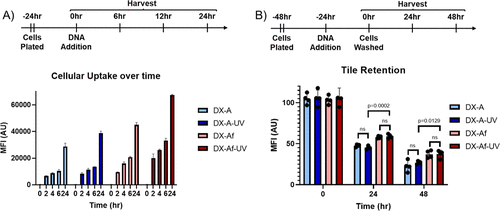
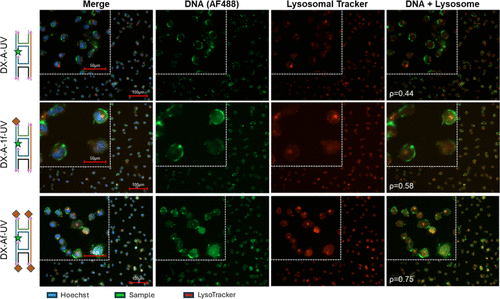
- 优化胞内动力学:研究揭示了纳米材料在胞内的滞留与导出机制,确定了高稳定性DNA结构更适用于长时间靶向递送。
未来展望与应用前景
此项研究不仅展示了UV交联技术在纳米材料稳定性上的优势,还为精准靶向递送提供了新思路:
- 纳米医学发展:DNA纳米材料的稳定性增强,使其成为癌症治疗的潜在递送平台,可用于基因疗法和靶向药物。
- 生物标记与诊断:DNA纳米技术可用于制造高度精确的生物标记物,提高疾病检测的灵敏度。
- 细胞表面工程:通过优化纳米材料的图案化,可以开发新型细胞工程策略,以精确控制细胞相互作用。
结论
这项研究突破了DNA纳米材料的稳定性限制,并优化了叶酸配体的空间排列,为靶向递送和基因沉默提供了更精确、更稳定的解决方案。UV交联技术在纳米医学领域的应用潜力巨大,未来可能在癌症治疗和精准生物工程领域发挥重要作用。
参考文献
Brown, T. M.; Saliba, D.; Hartmann, J.; Asohan, J.; Yao, C.; Das, T.; Sleiman, H. F. UV-Cross-Linked DNA Nanomaterials Enable Robust Nanopatterning of Folate Ligands for Enhanced Cellular Uptake. J. Am. Chem. Soc. 2025, jacs.5c02986. https://doi.org/10.1021/jacs.5c02986.