【Adv.Mater.】巨噬细胞介导的癌症免疫治疗:吞噬激活纳米复合物的作用
简介
本研究提出了一种增强巨噬细胞吞噬癌细胞的策略,即通过纳米复合物同时调控“吃我”信号(CALR蛋白)和“别吃我”信号(CD47蛋白),以提高癌症免疫治疗的效果。该纳米复合物(MNC CD47i-CALRt)在多种小鼠结直肠癌模型和患者来源的肿瘤类器官模型中显示出良好的抗肿瘤作用,同时具有极低的造血毒性。
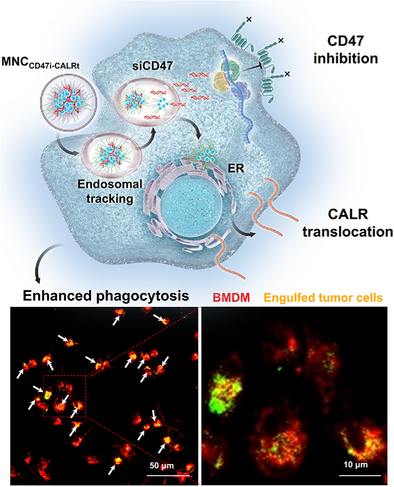
摘要
癌症细胞通过上调CD47(“别吃我”信号)和低表达CALR(“吃我”信号)来逃避巨噬细胞的吞噬。本研究设计了一种基于高分子聚合物的纳米复合物(MNC CD47i-CALRt),能够同时抑制CD47表达并诱导CALR暴露,以增强癌细胞的吞噬效应。纳米复合物由具有内在诱导CALR暴露能力的G4P–C7A聚合物和靶向CD47的小干扰RNA(siRNA)组成。在多个小鼠结直肠癌模型中,该纳米复合物显著延缓了肿瘤生长并延长了存活时间,并在患者来源的肿瘤类器官模型中得到了验证,为增强巨噬细胞介导的癌症免疫治疗提供了一种创新策略。
研究结果与讨论
CD47和CALR的共同调控增强巨噬细胞吞噬作用
研究通过分析TCGA数据库数据和免疫组织化学实验发现,CD47在结直肠癌患者肿瘤组织中显著上调。进一步的实验表明,抑制CD47表达或人工标记CALR蛋白均可单独提升巨噬细胞的吞噬能力,而两者结合可产生显著的协同效应。
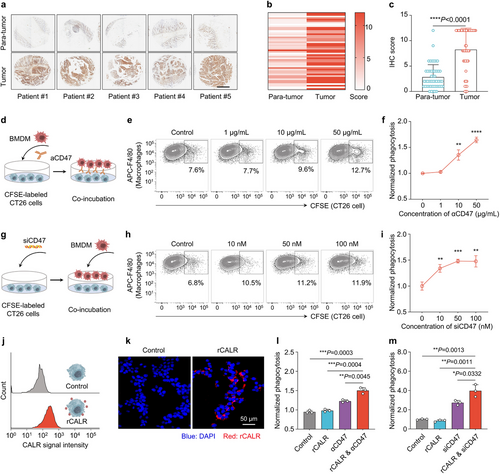
G4P–C7A的机制研究
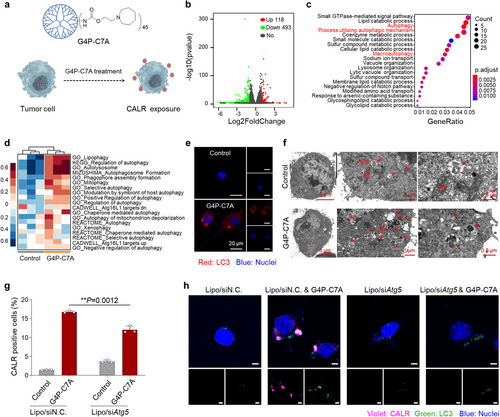
研究发现,G4P–C7A可显著提高肿瘤细胞表面的CALR暴露。RNA测序分析表明,该过程涉及自噬通路的激活,进一步实验验证了自噬在促进CALR暴露方面的关键作用。G4P–C7A可增强LC3表达,并在电子显微镜观察中发现大量自噬体的形成。
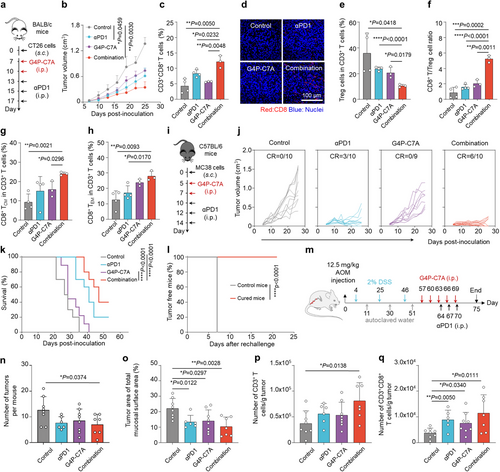
G4P–C7A与免疫检查点抑制剂的联合治疗
在CT26结直肠癌小鼠模型中,单独使用G4P–C7A可减缓肿瘤生长,而与抗PD-1抗体联合使用可增强抗肿瘤免疫反应,并显著减少Treg细胞比例,提高CD8+ T细胞浸润。
MNC CD47i-CALRt的构建与功能验证
研究通过修饰G4P–C7A形成PEG化的G4P–C7A,并与siCD47形成纳米复合物。流式细胞分析显示,该纳米复合物可显著降低CD47表达,并促进CALR暴露,最终增强巨噬细胞吞噬肿瘤细胞的能力。
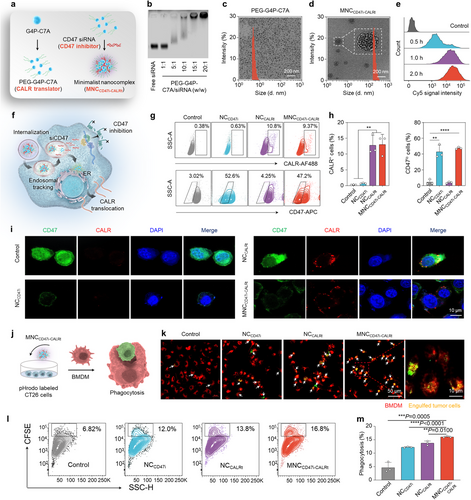
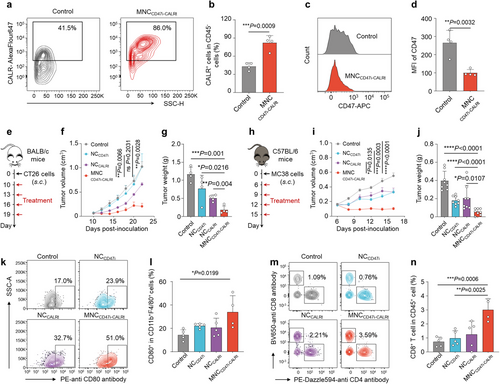
MNC CD47i-CALRt的体内抗肿瘤效果
在小鼠结直肠癌模型中,该纳米复合物可显著抑制肿瘤生长,CD47表达减少,CALR阳性细胞比例增加。此外,该治疗策略有效提升了肿瘤微环境中的CD80+巨噬细胞和CD8+ T细胞数量,增强了抗肿瘤免疫反应。
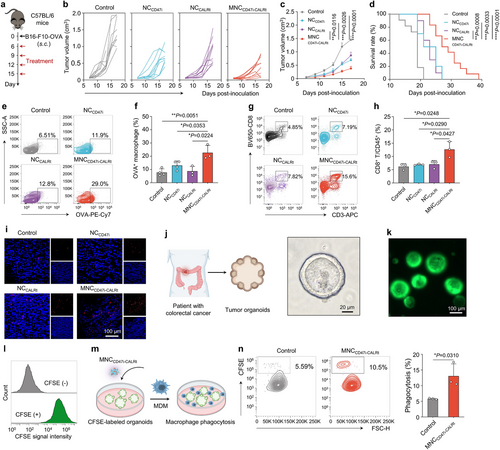
结论
本研究提出了一种结合CD47抑制与CALR诱导的癌症免疫治疗策略,利用纳米复合物MNC CD47i-CALRt有效促进巨噬细胞吞噬癌细胞,改善肿瘤免疫微环境。该策略在小鼠模型和患者来源的类器官模型中均表现出显著的抗肿瘤效应,为癌症免疫治疗提供了新思路。