【JACS】新型近红外二区狂犬病毒纳米诊疗探针,可跨越血脑屏障,离狂犬病毒治愈又近一步!
简介
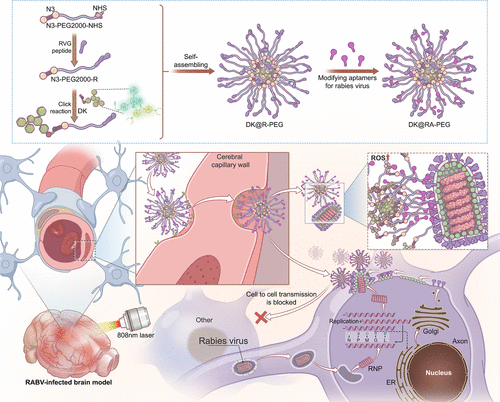
狂犬病是一种几乎致死率100%的病毒性疾病,目前尚无有效的临床治疗方法。本研究开发了一种可跨越血脑屏障(BBB)并精准靶向狂犬病毒(RABV)的荧光纳米诊疗探针,可用于安全的光动力治疗(PDT)。该探针基于新型NIR-II聚乙炔荧光分子DK,并通过点击化学与纳米载体结合,最终修饰特异性识别狂犬病毒糖蛋白(RVG)的适配体,实现高效成像与治疗。
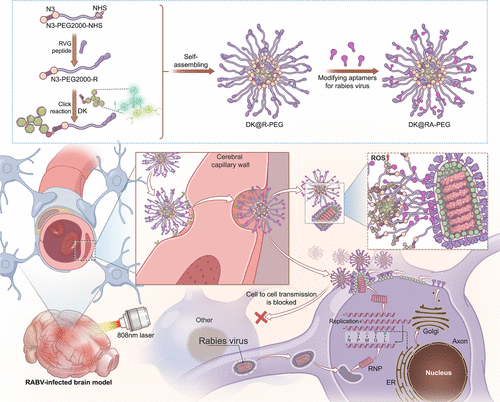
摘要
本研究开发了一种创新型NIR-II荧光纳米诊疗探针,DK@RA-PEG,其具有良好的生物相容性和跨BBB能力。该探针能够精准靶向狂犬病毒感染部位,并在光照下安全地进行光动力治疗,而不会产生热效应。研究显示,该探针在小鼠模型中成功实现狂犬病毒靶向成像,并提高生存率约40%。体外实验进一步证实,其在不同狂犬病病毒株(CVS、SHBRV和DRV)中均具有显著的光动力灭活效果。该研究为狂犬病治疗提供了新方法,并展现了NIR-II成像与PDT结合的潜力。
研究结果与讨论
光诊疗探针的分子设计与合成
本研究设计并合成了DK分子,该分子具有优异的光学特性,包括较大的斯托克斯位移、高量子产率和稳定的光照性能。DK的荧光量子产率为0.11%,且在不同有机溶剂中呈现良好的光谱吸收和发射特性。
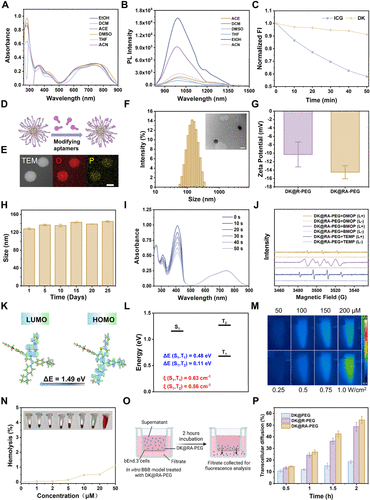
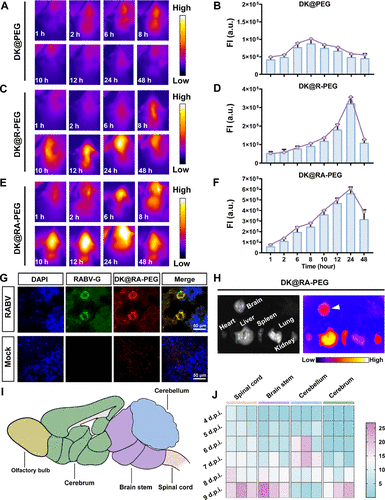
探针的跨血脑屏障能力
研究表明,DK@RA-PEG较未修饰RVG的探针DK@PEG更能有效跨越BBB并靶向中枢神经系统(CNS),其中在小鼠体内观察到其在24小时内达到最高脑部聚集。
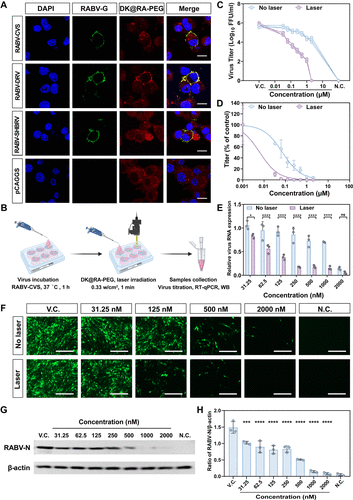
光动力抗病毒作用
体外实验显示,DK@RA-PEG在808 nm激光照射下可显著抑制狂犬病毒复制,病毒滴度下降12倍,EC50降低至6.23 nM。免疫荧光和Western blot分析进一步确认病毒蛋白表达减少,提示其能够有效灭活不同狂犬病毒株。
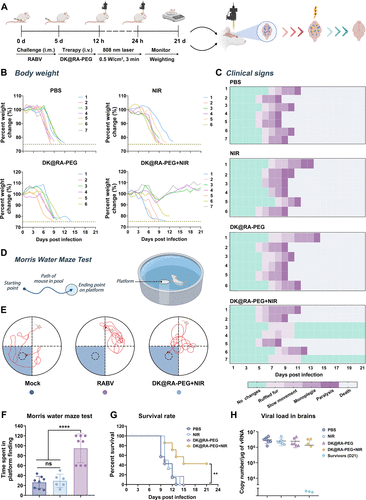
体内治疗效果
在小鼠狂犬病感染模型中,DK@RA-PEG结合PDT可显著提高生存率,治疗后40%的小鼠存活,而未治疗组均在14天内死亡。此外,治疗组的小鼠体重恢复正常,且无明显行为异常,验证了其良好的生物安全性。
结论
本研究成功开发了一种新型NIR-II荧光纳米探针DK@RA-PEG,能够跨BBB靶向狂犬病毒并实现安全光动力治疗。该探针结合高效病毒靶向性、深度组织成像能力及精准治疗特性,具有潜在的临床应用前景,为狂犬病治疗提供了新的策略。未来研究可进一步优化探针结构,提高生物安全性和治疗效率,推动其向临床应用发展。