【Angew.Chem.】基于缺氧触发的生物还原型光敏剂,可切换光声成像与高特异性癌症光治疗研究
简介
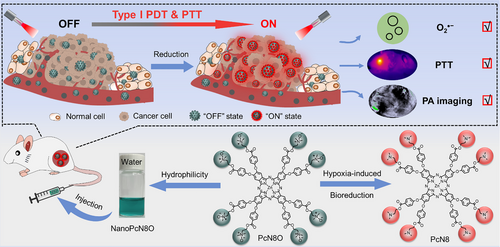
缺氧环境是肿瘤微环境的重要特征之一,影响肿瘤增殖、侵袭和耐药性。光动力疗法(PDT)依赖氧分子生成活性氧(ROS)以杀死癌细胞,但传统PDT在缺氧环境下疗效受限。本研究开发了一种新型光敏剂NanoPcN8O,可在肿瘤缺氧微环境下生物还原,从而开启I型光动力效应和光热效应,同时激活光声成像,实现精准肿瘤治疗。
摘要
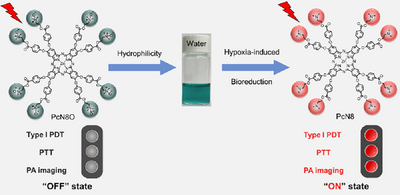
本研究提出了一种基于八氧化氮取代酞菁(PcN8O)的光敏剂,其自组装形成纳米颗粒(NanoPcN8O),并在缺氧环境下发生生物还原,转化为富电子叔胺结构的NanoPcN8,从而激活I型光动力效应,生成超氧自由基(O₂•⁻)和羟基自由基(OH•),并通过光热效应释放热量。此外,该纳米光敏剂还可在肿瘤模型中实现缺氧诱导的选择性光声成像。通过体内实验,NanoPcN8O展现出卓越的抗肿瘤疗效,同时降低了传统光敏剂的皮肤光毒性风险。该研究为缺氧耐受型光治疗提供了新的策略,并有望推动光动力治疗在临床应用中的发展。
研究结果与讨论
NanoPcN8O的设计与合成
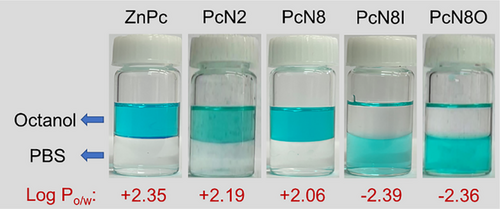
酞菁(Pc)因其优异的光化学特性被广泛用于光治疗,但其水溶性差限制了其应用。本研究通过在Pc结构中引入多个N-氧化基团,合成了PcN8O,并发现其在水相中可形成稳定的纳米分散体系(NanoPcN8O),其最大浓度可达29 mg/mL。纳米粒子的形成机制经分子动力学模拟确认,显示其主要由π-π堆积和亲水相互作用驱动。
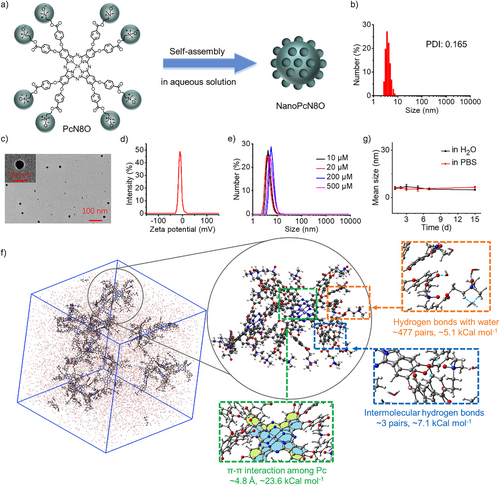
NanoPcN8O的缺氧诱导生物还原
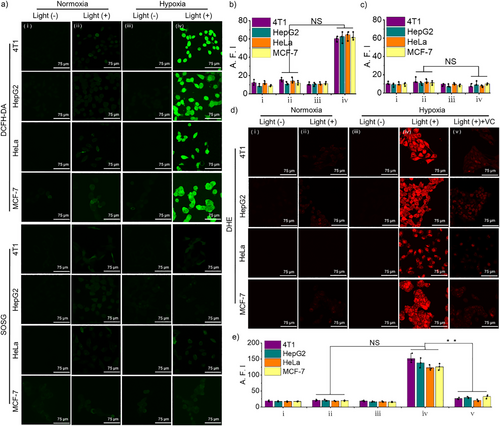
缺氧环境下,肿瘤细胞富含NADPH和细胞色素P450(CYP450),可促使NanoPcN8O发生生物还原,转化为NanoPcN8。实验结果表明,NanoPcN8O在缺氧环境下的粒径显著增大,Zeta电位从负值变为正值,吸收光谱发生明显变化。此外,核磁共振(NMR)和高分辨质谱(HRMS)分析证实了N-氧化基团的还原。
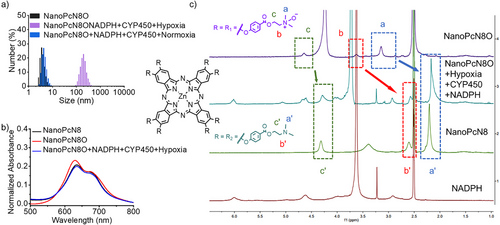
NanoPcN8O的光动力与光热效应
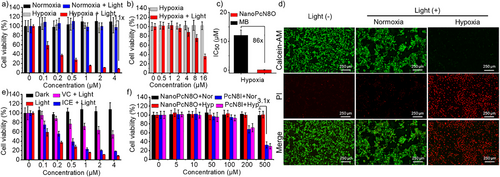
在缺氧条件下生物还原后的NanoPcN8展示出强烈的I型光动力效应,能够高效产生超氧自由基(O₂•⁻)和羟基自由基(OH•),其ROS产量显著高于商业光敏剂亚甲蓝(MB)。此外,NanoPcN8在激光照射下可产生显著热量,展现优异的光热转换能力,有助于协同光治疗作用。
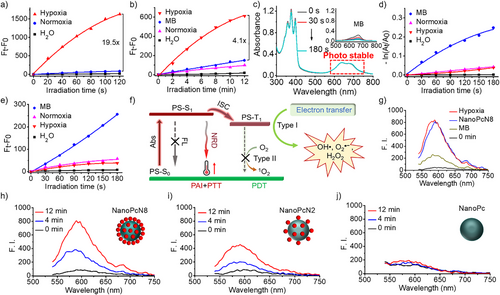
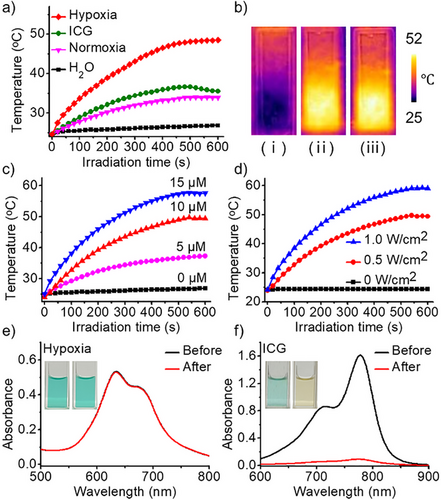
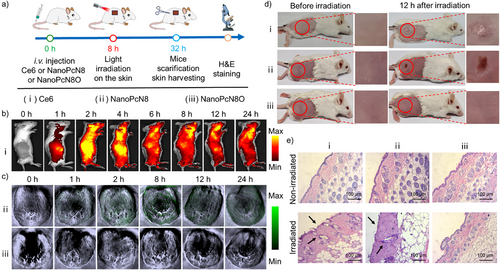
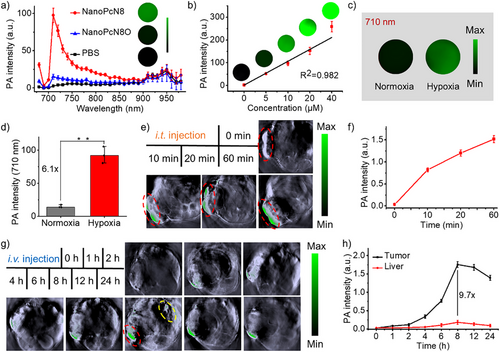
光声成像与体内治疗效果
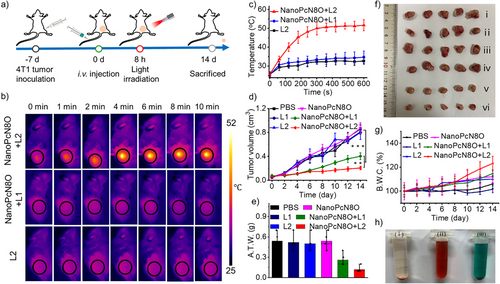
NanoPcN8O可在肿瘤模型中实现缺氧触发的光声信号增强,具有较好的肿瘤成像能力。体内实验显示,该光敏剂可有效抑制肿瘤生长,并且不会引发常规光敏剂的皮肤光毒性,增强了生物安全性。这些特性使NanoPcN8O成为一种高效、安全的肿瘤光治疗候选药物。
结论
本研究成功开发了一种缺氧响应型光敏剂NanoPcN8O,其可在肿瘤微环境中实现选择性生物还原,激活光动力与光热效应,同时支持光声成像。该设计策略可有效克服缺氧耐受问题,提高光治疗的特异性与安全性,为肿瘤治疗提供新的思路。