【Adv.Mater.】通过微生物光合氧化和放射治疗增敏诱导细胞焦亡的癌症联合治疗策略
简介
结直肠癌是一种高发病率、高死亡率的恶性肿瘤,尤其是低位直肠癌,其局部复发率高,严重影响患者生活质量。放射治疗(RT)是重要的治疗手段,但由于肿瘤缺氧环境,其疗效受到限制。为克服这一挑战,本研究开发了一种结合光合微生物与放射增敏纳米材料的生物平台,以提高RT效能并诱导细胞焦亡,从而增强抗肿瘤效果。

摘要
传统RT在治疗直肠癌时受到肿瘤缺氧环境和凋亡抗性影响,降低了治疗效果。本研究提出了一种综合策略,通过光合微生物(蓝藻)产氧改善肿瘤缺氧,并结合镧氧化物纳米颗粒(La₂O₃ NPs)提高放射治疗的能量沉积,增强活性氧(ROS)产生,最终诱导焦亡。该方法通过热敏水凝胶实现精准治疗,提高治疗特异性并减少全身毒性。体内外实验验证了其在缓解肿瘤缺氧、提高放疗敏感性及触发焦亡方面的卓越疗效,为未来临床癌症治疗提供新的思路。
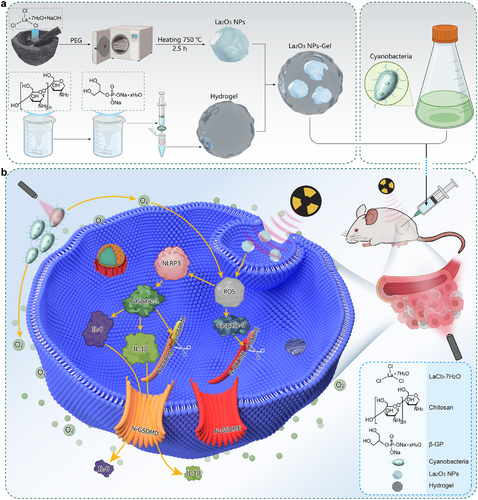
研究结果与讨论
1. 肿瘤缺氧与放疗抗性
肿瘤缺氧降低ROS生成,限制DNA损伤,从而降低放疗诱导的细胞死亡。缺氧还激活DNA修复通路,稳定低氧诱导因子1α,促进肿瘤存活,并增强癌干细胞的生存能力,导致肿瘤复发。
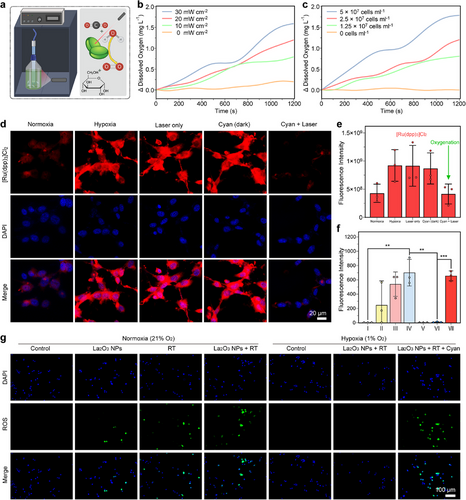
2. 蓝藻光合作用缓解缺氧
实验表明,在660 nm激光照射下,蓝藻可以显著提高溶解氧水平,并在CT26肿瘤细胞共培养实验中降低低氧指示剂的荧光强度,证明其能够有效改善肿瘤微环境,提高细胞对RT的敏感性。
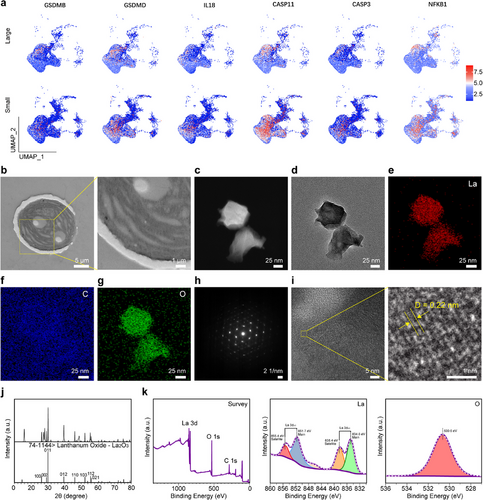
3. La₂O₃ NPs增强放疗效能
La₂O₃ NPs具有高原子序数特性,可以有效吸收低能X射线,产生次级电子,加强ROS生成,进一步放大RT的氧化应激反应,增强细胞损伤。其与蓝藻联合使用能够在缺氧条件下恢复ROS水平,使肿瘤细胞死亡率显著提高。
4. 焦亡诱导克服凋亡抗性
相比于凋亡,焦亡是一种高度免疫原性的细胞死亡方式,其由气孔蛋白家族(GSDMD和GSDME)介导,在某些癌细胞中比凋亡更加有效。放疗可通过GSDME诱导焦亡,而La₂O₃ NPs则激活ROS-NLRP3-GSDMD通路,从而触发双路径焦亡,提高抗肿瘤免疫响应。
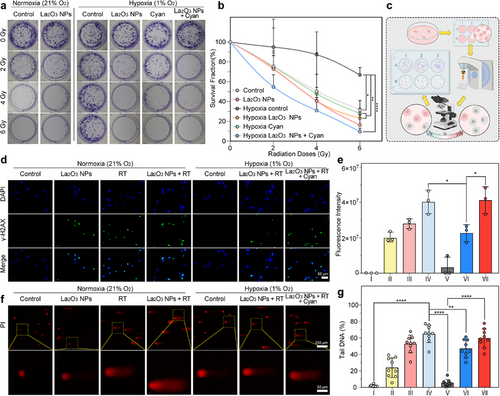

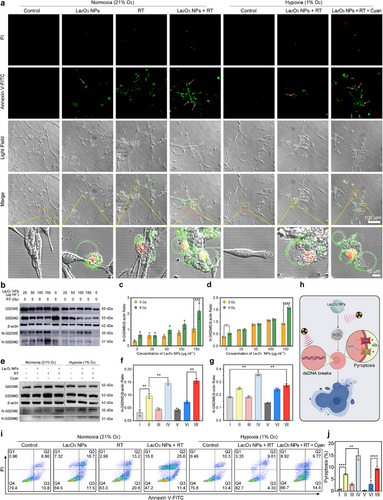
5. 体内与体外治疗效果验证
体外实验显示,蓝藻-放疗增敏联合治疗在缺氧条件下恢复了细胞焦亡水平,提高了细胞死亡率。动物实验进一步验证了该生物平台能够显著降低肿瘤负荷,并在转录组分析中显示其有效调控氧化应激与炎症通路,证明其治疗机制的有效性。
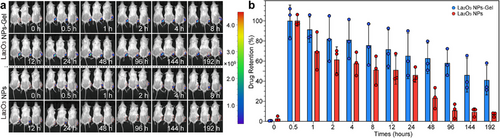
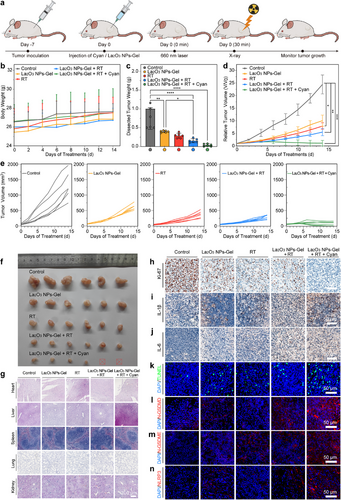
结论
本研究提出了一种创新的癌症联合治疗策略,通过蓝藻光合产氧和La₂O₃ NPs放疗增敏作用,同时缓解缺氧、增强放疗效能并诱导细胞焦亡。该方法有望突破传统RT局限,为临床癌症治疗提供新方案。