【Biomaterials】声动力激活纳米粒子促进二硫化死亡,膀胱癌免疫治疗新突破
简介
该研究开发了一种新型的可降解声动力假共轭聚合物(SPCP)和含胱氨酸聚合物(CCP)纳米系统(SPCP/ CCP@Bay ),用于诱导膀胱癌细胞的二硫化死亡,并改善肿瘤免疫治疗效果。 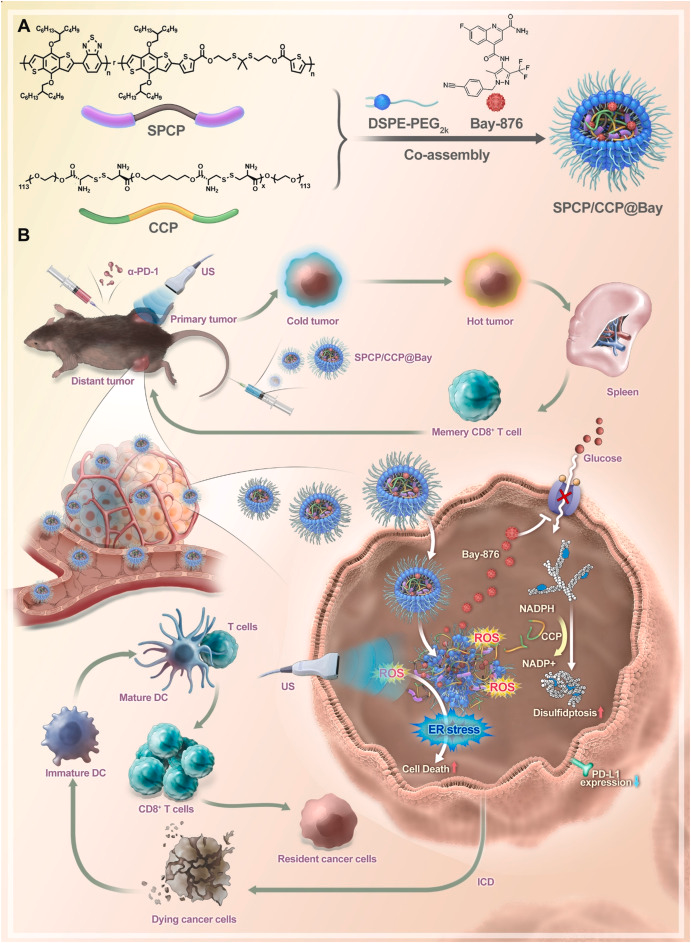
摘要
二硫化死亡是一种以胱氨酸累积和二硫化物应激为特征的新型程序性细胞死亡方式,主要发生在代谢活跃的肿瘤中。本文报道了一种纳米技术与声动力疗法(SDT)相结合的方法,通过 SPCP/ CCP@Bay 系统在超声照射下释放 Bay-876,从而诱导二硫化死亡。同时,该系统还促进了免疫原性细胞死亡(ICD),并与 PD-1 单克隆抗体协同抑制肿瘤生长。这种集成策略在重塑肿瘤微环境、将“冷肿瘤”转化为“热肿瘤”方面显示出显著潜力,有望推进癌症免疫治疗领域的发展。
研究结果与讨论
SPCP/ CCP@Bay 的制备与表征
SPCP 通过 Stille 聚合反应合成,CCP 则通过缩合聚合反应合成。SPCP 和 CCP 与 Bay 共组装形成纳米复合物 SPCP/ CCP@Bay 。透射电子显微镜(TEM)和动态光散射(DLS)结果显示,该纳米复合物具有均匀的球形结构和良好的分散性。 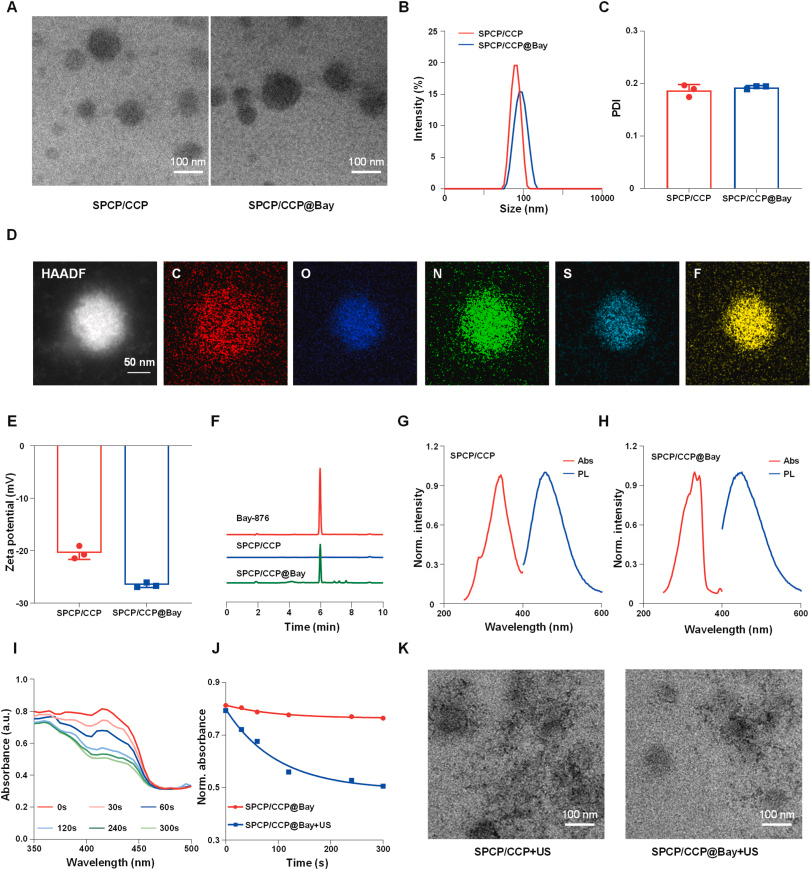
SPCP/ CCP@Bay 在膀胱癌细胞中的内吞、ROS 生成和细胞毒性
实验表明,SPCP/ CCP@Bay 在超声照射下能有效被膀胱癌细胞内吞,并生成大量活性氧(ROS),从而诱导肿瘤细胞的死亡。体外细胞毒性实验结果表明,SPCP/ CCP@Bay 在超声照射下具有显著的抗癌效果。

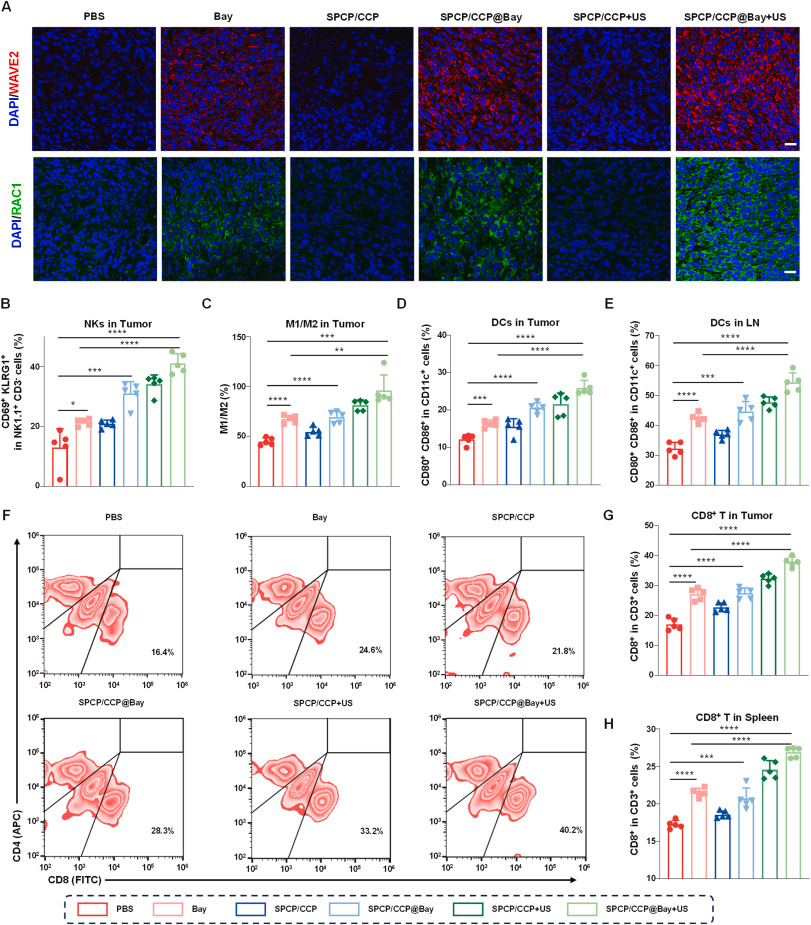
SPCP/ CCP@Bay 诱导二硫化死亡的机制
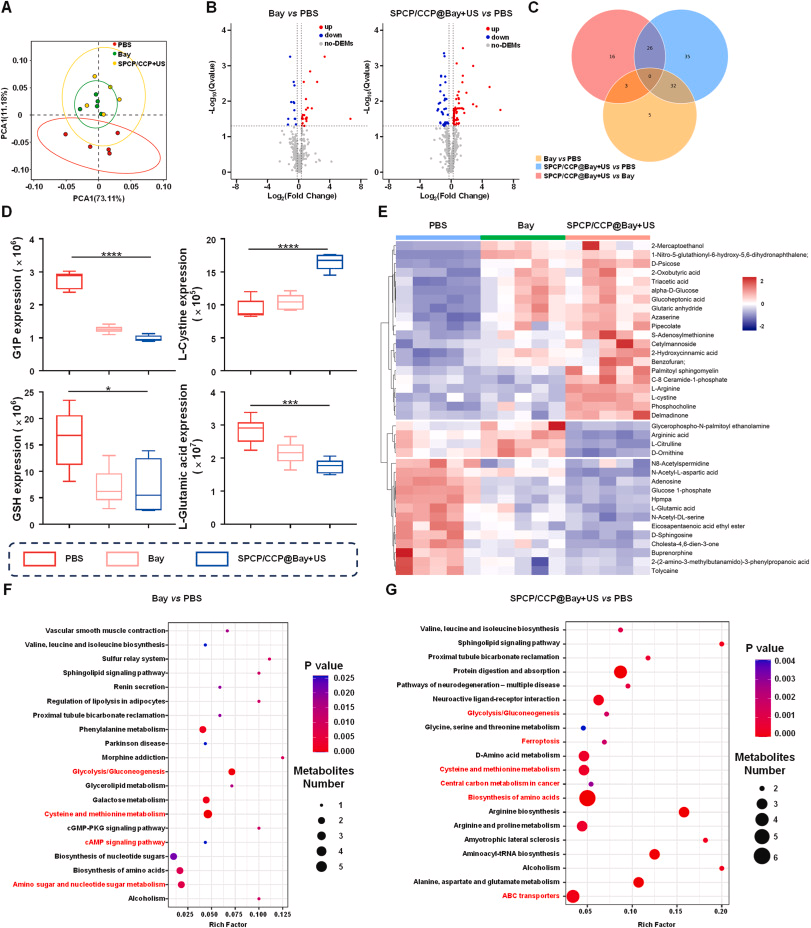
SPCP/ CCP@Bay 在超声照射下能够显著增加肿瘤细胞的 NADPH 消耗,并激活 RAC1/WAVE2 信号通路,从而诱导细胞骨架收缩,促进二硫化死亡。此外,代谢组学分析进一步验证了 SPCP/ CCP@Bay 在超声照射下对肿瘤细胞代谢的影响。 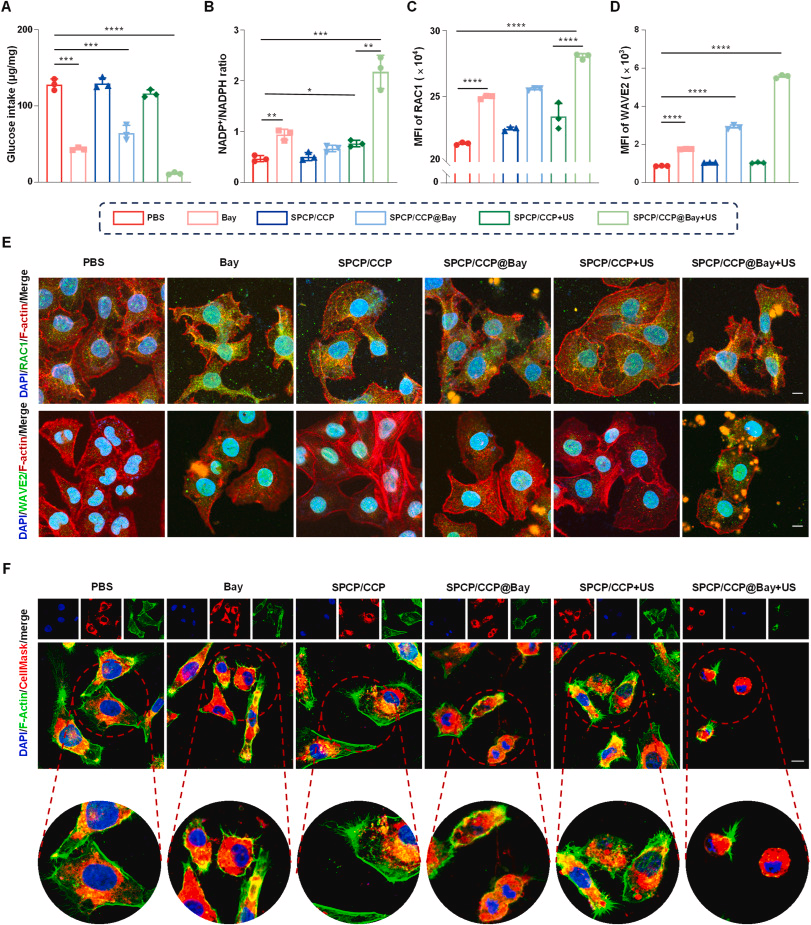
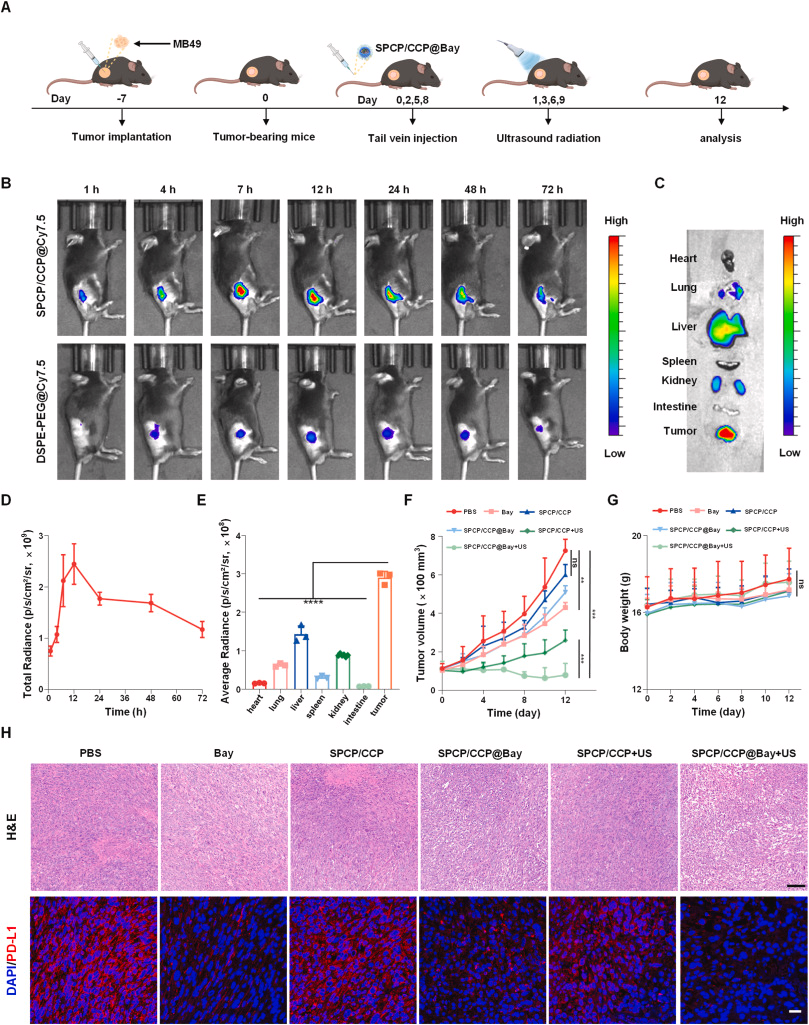
SPCP/CCP@Bay在体内的抗肿瘤效果
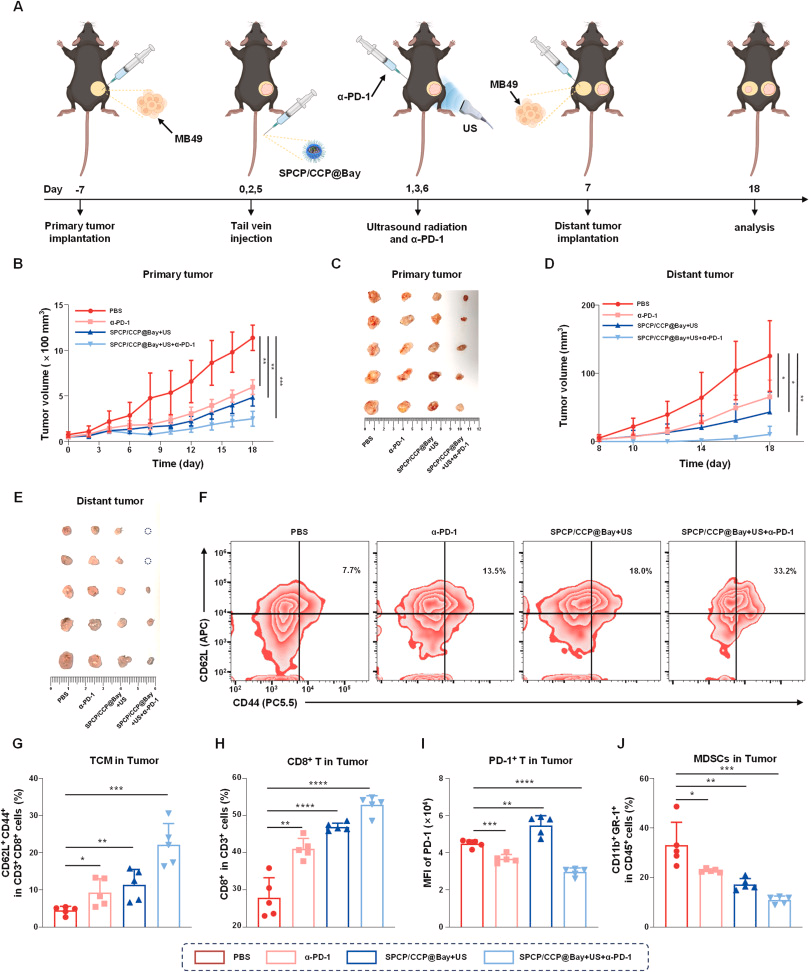
通过小鼠模型实验,研究人员发现SPCP/ CCP@Bay 在超声照射下能够显著抑制肿瘤生长,并通过诱导免疫原性细胞死亡(ICD)改善肿瘤免疫微环境。此外,SPCP/ CCP@Bay 与PD-1单克隆抗体联合使用,进一步提高了抗肿瘤效果。 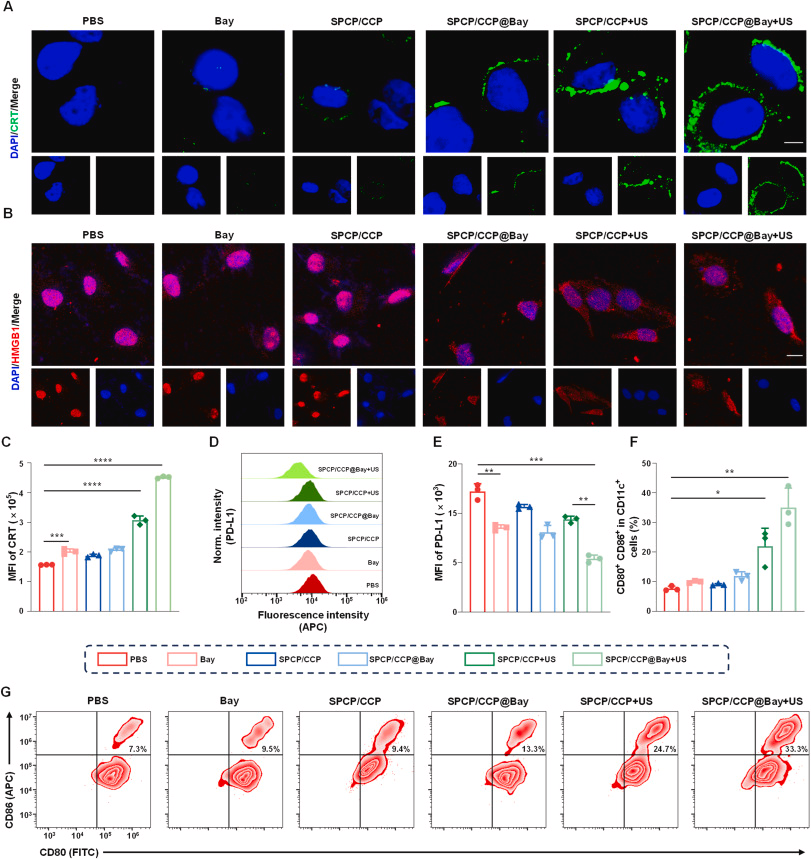
结论
该研究通过结合纳米技术和声动力疗法,开发了一种新型的抗肿瘤策略——SPCP/ CCP@Bay 系统。该系统在超声照射下能够有效诱导二硫化死亡,改善肿瘤免疫治疗效果,并显著抑制肿瘤生长和转移。这一综合策略在膀胱癌的治疗中展现出巨大的潜力,有望为癌症免疫治疗领域带来新的突破。
参考文献
Wang, K.; Li, L.; Liang, G.; Xiao, H.; Zhang, L.; Liu, T. Sonodynamic Activated Nanoparticles with Glut1 Inhibitor and Cystine-Containing Polymer Stimulate Disulfidptosis for Improved Immunotherapy in Bladder Cancer. Biomaterials 2025, 319, 123178. https://doi.org/10.1016/j.biomaterials.2025.123178.