【JACS】只用调节烷基链的长度就可以实现不同功能的细胞成像
总结
研究开发了一系列亲脂性可调的荧光探针,用于选择性标记细胞微泡(MVs)。这些探针通过调节脂肪链长度,实现了对不同细胞膜环境的特异性标记,揭示了MVs的生成、融合和裂变过程。
摘要
本研究提出了一种通过调节荧光探针亲脂性的方法,选择性标记细胞微泡(MVs)。研究开发了一系列脂层敏感的阳离子吲哚香豆素荧光探针(IC-Cn,n从1到18),这些探针具有不同长度的脂肪链(CnH2n+1)。通过原位细胞成像和分析,发现IC-Cn的定位与其亲脂性和细胞内磷脂层的疏水微环境密切相关。具体而言,IC-C1和IC-C2特异性标记细胞内外的MVs,而IC-C3、IC-C4和IC-C5则标记细胞MVs和线粒体,但具有不同的荧光寿命。利用这些探针,研究发现除了MVs从质膜和受损线粒体生成外,新形成的MVs还可以经历融合和裂变过程。此外,线粒体衍生的MVs不仅从母细胞释放,还可以与溶酶体融合,促进受损线粒体的清除。这项工作不仅提供了对MV生理的新见解,还为细胞研究中探针的设计策略提供了灵感。
研究结果分类展示
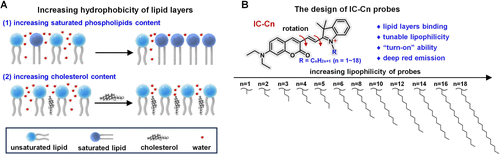
探针设计与合成
- 设计思路:通过引入不同长度的脂肪链(CnH2n+1)调节探针的亲脂性。
- 合成方法:采用Knoevenagel反应合成IC-Cn探针。
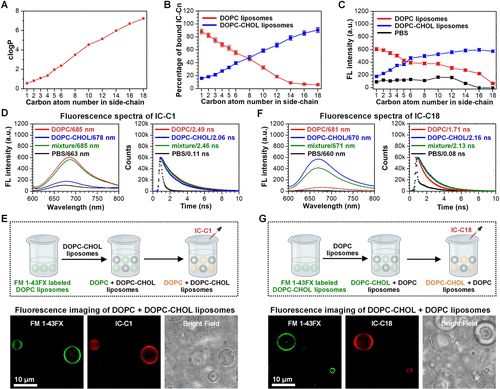
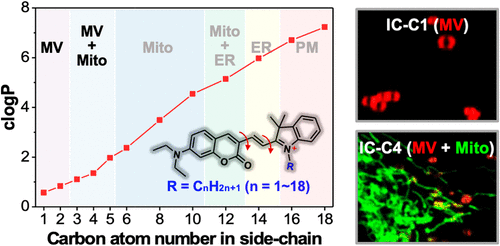
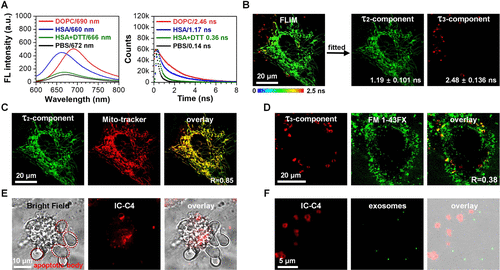
探针的亲脂性与标记效率
- 亲脂性评估:通过计算logP值评估探针的亲脂性,发现随着脂肪链长度的增加,探针的亲脂性显著增强。
- 标记效率:IC-C1和IC-C2特异性标记MVs,而IC-C3、IC-C4和IC-C5则标记MVs和线粒体。
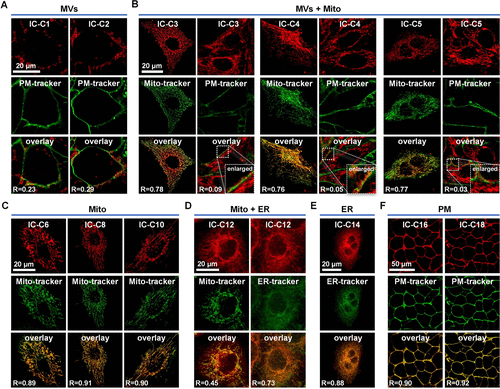
MVs的生成、融合和裂变
- 生成过程:MVs从质膜和受损线粒体生成。
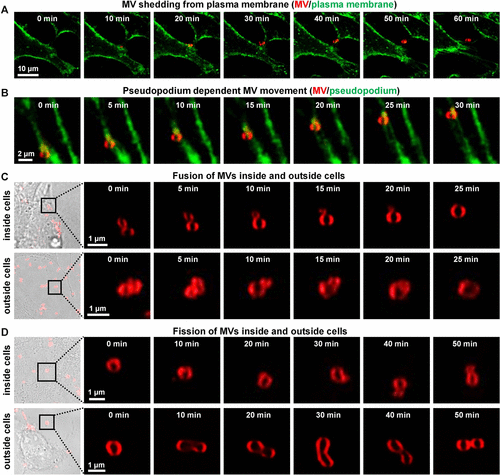
- 融合过程:新形成的MVs可以经历融合过程。
- 裂变过程:MVs可以经历裂变过程,形成两个较小的子MVs。
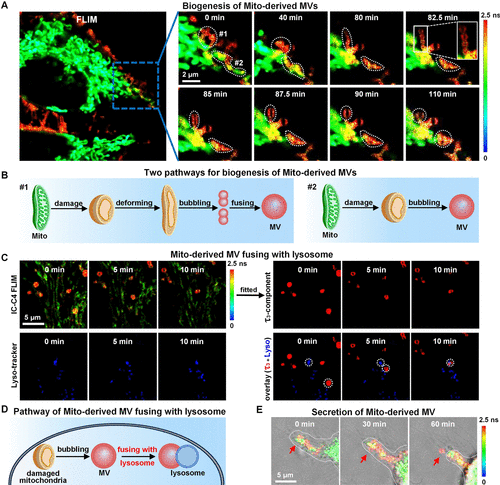
这项研究展示了调节荧光探针亲脂性在选择性标记细胞微泡中的巨大潜力,为未来的细胞研究提供了新的思路和方法。详细信息可以在这里找到。
参考文献
Huang, W.; Han, G.; Wang, D.; Zhu, Y.; Wang, H.; Liu, Z.; Uvdal, K.; Geng, J.; Hu, Z.; Zhang, R.; Zhang, Z. Lipophilicity Modulation of Fluorescent Probes for In Situ Imaging of Cellular Microvesicle Dynamics. J. Am. Chem. Soc. 2025, jacs.4c13516. https://doi.org/10.1021/jacs.4c13516.