【Adv.Mater.】克服实体瘤免疫抑制,新型细胞表面锚定核酸治疗策略显著增强ACT的抗肿瘤效果
简介
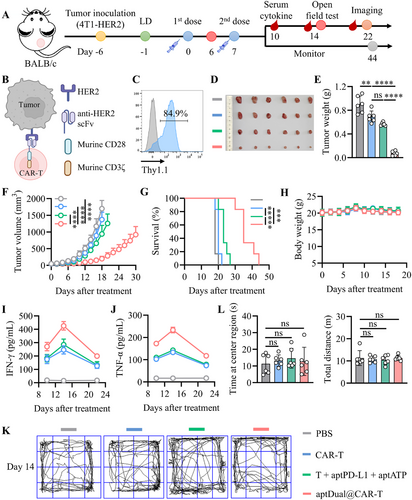
适应性T细胞疗法(ACT)在治疗血液恶性肿瘤方面展现出巨大潜力,但在实体瘤中的疗效受限于免疫抑制性肿瘤微环境(TME)。针对这一挑战,本研究提出细胞表面锚定核酸治疗(NATs)策略,以协同抑制免疫抑制性的腺苷和PD-1/PD-L1通路,从而增强ACT的抗肿瘤效果。
摘要
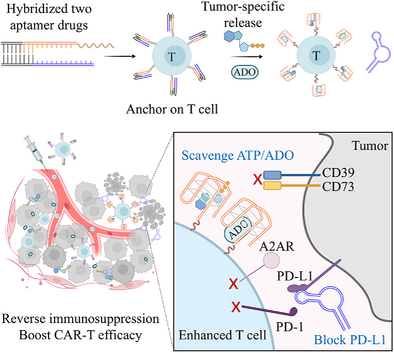
采用细胞表面锚定核酸治疗策略,通过DNA适配体(aptPD-L1和aptATP)构建部分杂交双链结构(aptDual),在T细胞表面锚定后进行转移。aptDual在体内与ACT细胞共同浸润TME,结合ATP后促使适配体解离,释放aptPD-L1,同时aptATP清除外泌ATP及其代谢产物腺苷,以阻断腺苷信号轴,增强T细胞对免疫检查点抑制的响应。此双重抑制策略显著提高肿瘤浸润ACT细胞的功能性,使TCR-T和CAR-T细胞在多种实体瘤模型中展现增强的抗肿瘤效能。
研究结果与讨论
适配体逆转体外免疫抑制
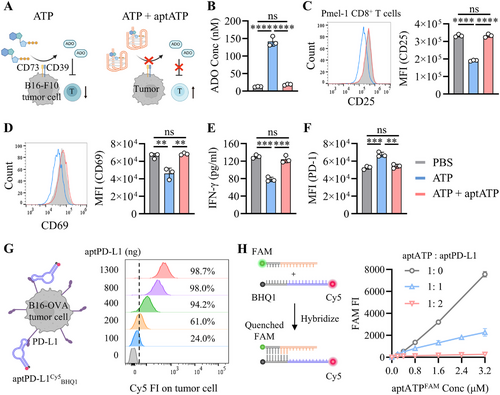
研究构建了能够结合PD-L1的aptPD-L1和结合ATP/腺苷的aptATP,并验证其在体外能够逆转腺苷诱导的T细胞免疫抑制现象。ATP的存在促进腺苷生成,而aptATP能够显著降低腺苷水平,恢复T细胞活性标志物(CD25、CD69)表达,并提高IFN-γ的分泌量,同时降低PD-1的表达水平。
aptDual对ATP响应解离特性
aptDual在PBS缓冲液中稳定存在,而在高浓度ATP环境中,aptDual解离释放aptPD-L1,启动免疫检查点抑制。实验进一步验证了APT在肿瘤组织溶液中可有效促使aptDual解离,表明该策略可在TME中特异性发挥作用。血清稳定性实验显示,aptDual在低浓度ATP的血清环境中保持稳定,确保其在体内具有足够的靶向作用时间。
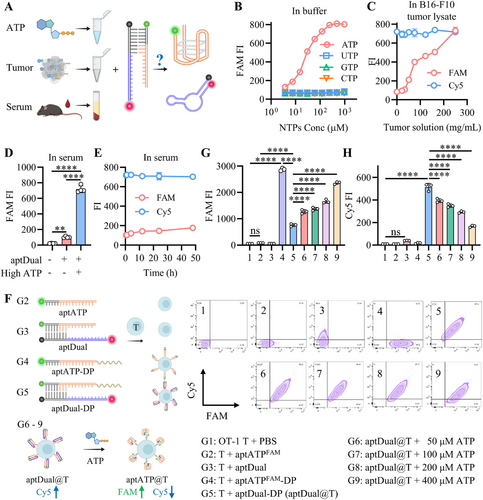
细胞表面锚定aptDual的稳定性和功能性
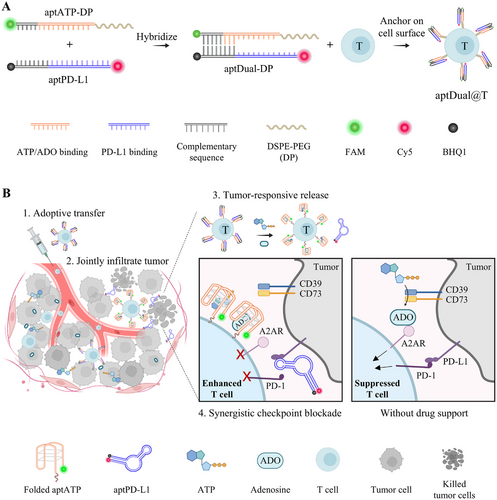
通过功能化脂质结构(DP)修饰aptATP,使其能够锚定于T细胞表面,形成aptDual@T。在T细胞膜上的锚定实验显示,aptDual@T在ATP刺激下能够有效解离,同时不影响T细胞的存活率、活性标志物表达及细胞因子分泌,证明其对T细胞功能的安全性。
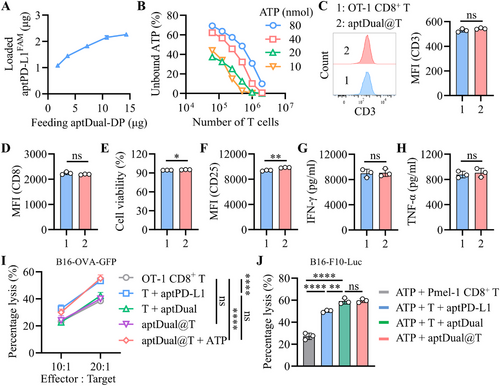
aptDual@T在体内的免疫增强作用
小鼠模型实验表明,aptDual@T在肿瘤部位的累积水平较游离aptDual提高约19倍,且存留时间大幅延长至至少72小时。转移至肿瘤微环境的aptDual@T能够显著减少腺苷水平,同时极大幅度提高肿瘤浸润的ACT细胞数量及IFN-γ+T细胞比例,相较于游离aptDual提高约40倍。此外,该策略还能促进内源性CD8+T细胞浸润,提高全体免疫应答能力。
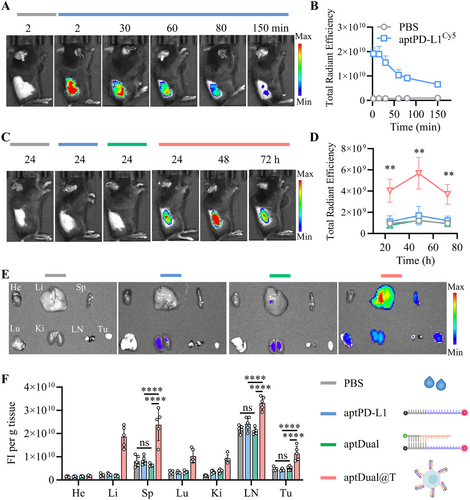
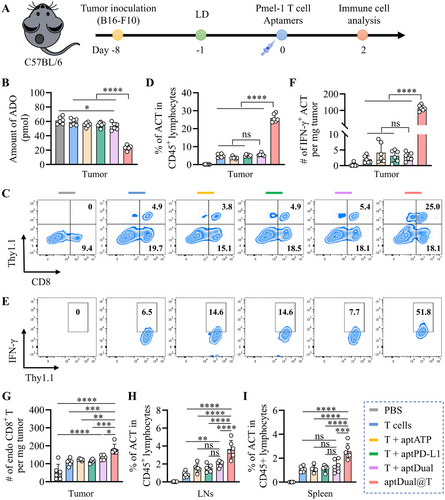
结论
细胞表面锚定的核酸治疗(NATs)通过ATP响应性的aptDual系统,能够特异性增强适应性T细胞治疗在实体瘤中的抗肿瘤免疫效能。研究证明该策略能有效协同阻断PD-1/PD-L1及腺苷信号通路,增强ACT细胞功能性,显著提高抗肿瘤反应,为实体瘤免疫治疗提供了一种安全、高效、可拓展的新方法。