【JACS】精准光动力免疫治疗新突破——细胞膜破裂诱导强效抗癌免疫反应
研究背景与意义
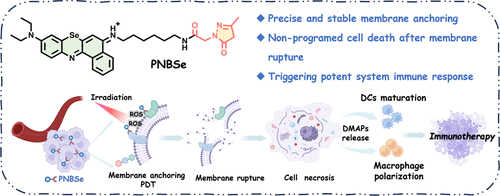
免疫治疗在癌症治疗领域展现出了巨大的潜力,能够通过激活免疫系统实现对肿瘤的有效清除。然而,传统的光动力疗法由于免疫原性不足及肿瘤微环境的免疫抑制作用,常常难以达到理想的治疗效果。近年来,非程序性细胞死亡(如细胞坏死)因其强烈的免疫刺激作用而受到关注。细胞坏死不仅能够释放大量损伤相关分子模式(DAMPs),还能够有效地激活免疫系统,为抗癌免疫治疗提供了新的思路。
研究创新与方法
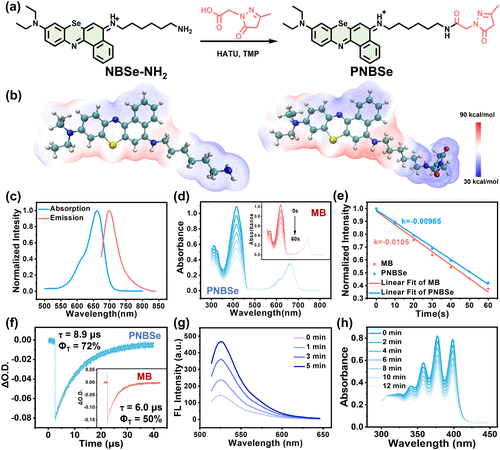
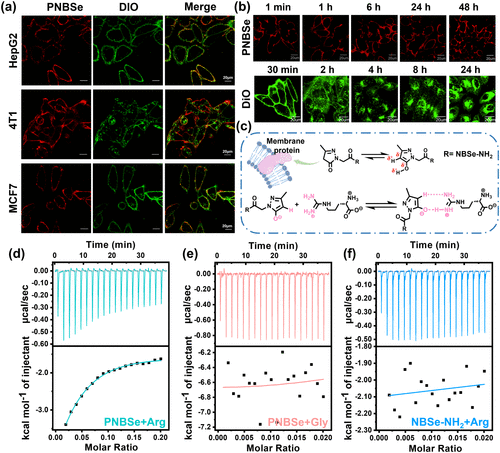
本研究设计了一种新型的光动力免疫治疗分子PNBSe,该分子通过硒取代的苯并苯硫氮化合物(NBSe-NH2)与吡唑酮基团的连接,实现了精准的细胞膜靶向作用。PNBSe的吡唑酮基团能够与膜蛋白中的氨基酸(如精氨酸)形成稳定的结合,从而保证药物在细胞膜上的长期锚定。
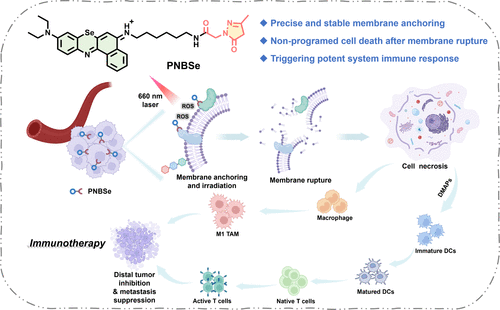
在光照作用下,PNBSe能够有效产生活性氧(ROS),诱导细胞膜氧化破裂,最终导致细胞的快速坏死。与传统光动力疗法相比,该过程能够在短时间内引发剧烈的细胞膜破坏,促进肿瘤抗原释放,进而激活炎症反应并重塑肿瘤免疫微环境。
研究结果与重要发现
高效活性氧产生能力
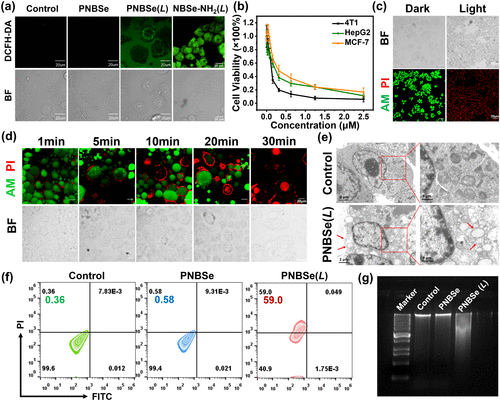
研究发现,PNBSe在660 nm光照条件下能够稳定地产生ROS,其量子产率高达72%,远高于传统光敏剂蓝色亚甲基染料(MB)的50%。光照后,PNBSe在细胞膜上的氧化作用能够迅速导致细胞膜完整性丧失,使细胞发生剧烈肿胀及内容物泄漏。
快速诱导细胞坏死
细胞实验结果表明,PNBSe在光照后可快速诱导细胞坏死,其半数抑制浓度(IC50)低至0.2 μM。与传统的凋亡过程不同,该过程呈现典型的非程序性坏死特征,如DNA碎片化、膜完整性破坏以及乳酸脱氢酶(LDH)泄漏等。
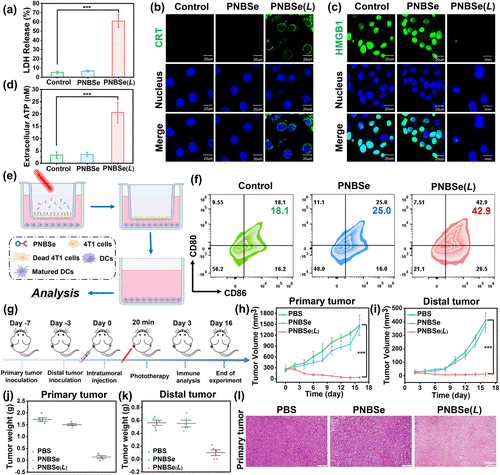
免疫原性细胞死亡(ICD)显著增强
该治疗策略能够有效触发DAMPs释放,包括钙网蛋白(CRT)、高迁移率族蛋白1(HMGB1)以及ATP。免疫荧光检测显示,PNBSe处理后的肿瘤细胞表现出显著的CRT外膜表达,HMGB1泄漏以及ATP的剧增,这些均是典型的ICD标志物,表明该策略能够强效激活机体免疫系统。
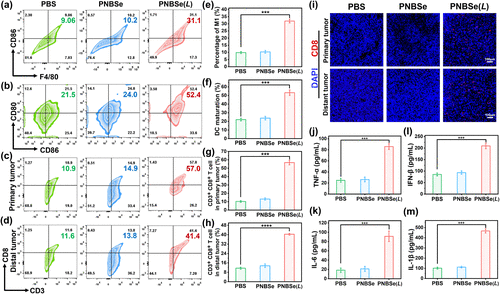
肿瘤微环境重塑及免疫激活
小鼠实验进一步证实,PNBSe能够有效重塑肿瘤微环境,诱导肿瘤相关巨噬细胞(TAMs)向M1型极化,提高促炎细胞因子(TNF-α、IL-6、INF-β和IL-1β)的分泌水平。此外,PNBSe还能促进树突状细胞(DCs)成熟,使CD8+细胞毒性T淋巴细胞(CTLs)大量浸润肿瘤区域,进一步增强适应性免疫响应。
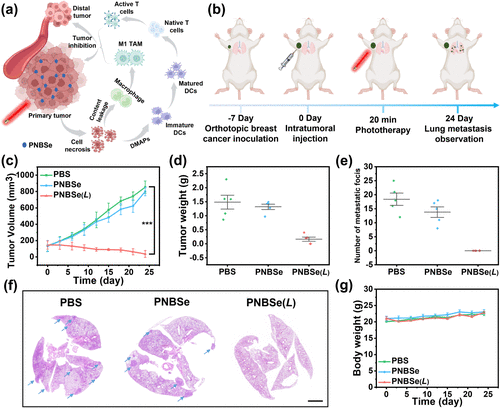
抑制远端肿瘤生长及防止转移
在双侧肿瘤模型研究中,PNBSe在原位肿瘤光照治疗后不仅有效抑制局部肿瘤生长(抑制率达97.8%),还显著减少远端肿瘤的生长(抑制率94.2%),展现出卓越的抗癌免疫记忆效应。此外,在乳腺癌肺转移模型实验中,PNBSe的治疗策略能够完全抑制肺部转移灶的形成,进一步证明其在癌症治疗中的巨大潜力。
研究影响与未来展望
本研究提出了一种基于细胞膜破裂的新型光动力免疫治疗策略,实现了非程序性细胞死亡诱导的肿瘤免疫激活,为癌症治疗提供了新的思路。PNBSe不仅具有高效的ROS生成能力,还能精准锚定细胞膜,保证光动力治疗的稳定性和有效性。这一创新策略展现出极高的抗肿瘤免疫效应,能够有效抑制原位肿瘤生长,并激活远端免疫响应,防止癌症转移,为光动力免疫治疗的发展奠定了重要基础。
未来,该策略有望进一步优化药物的光学性质,提高其生物相容性,以适应不同类型的肿瘤治疗需求。同时,该研究提供了一种新型的免疫调控方法,可与其他抗肿瘤治疗手段(如化疗、靶向治疗)联合使用,进一步增强癌症治疗的综合效果。通过未来的临床试验验证,PNBSe可能成为一种安全高效的免疫治疗药物,为患者提供更好的治疗选择。
这项研究展现了细胞膜破裂在光动力免疫治疗中的关键作用,并揭示了增强抗肿瘤免疫的数字化重要结果,推动了癌症治疗向精准、高效方向发展。
参考文献
Chen, Y.; Xiong, T.; Gu, M.; Li, M.; Chen, X.; Wang, L.; Fan, J.; Peng, X. Pyrazolone-Modified Photosensitizers for Precise Cell Membrane Rupture to Enhance Cancer Immunotherapy. J. Am. Chem. Soc. 2025, 147 (21), 17915–17925. https://doi.org/10.1021/jacs.5c02764.