【JACS】创新型光激活锰基一体化CO释放分子(CORMs):抗结核病菌感染的协同治疗新策略
结核病作为全球最常见的传染性疾病之一,严重威胁着人类健康。虽然现有药物如异烟肼、利福平和乙胺丁醇在临床上广泛使用,但结核菌日益增长的耐药性正在削弱这些药物的疗效,因此亟需新型治疗策略或安全有效的新药来对抗耐药机制。
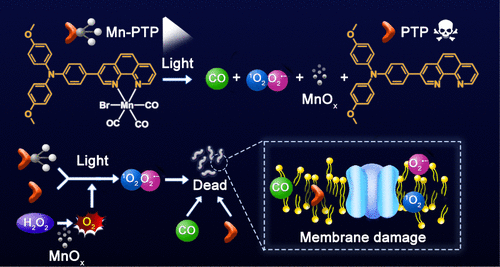
研究背景与创新目标
近年来,抗菌光激活疗法在医学领域引起广泛关注,而金属配合物作为潜在抗生素也被证明是对抗细菌感染的一种有效手段。此外,一氧化碳(CO)气体疗法也在抗菌研究中显示出应用前景。因此,研究者希望能设计一种能够结合光激活疗法与CO气体疗法的金属配合物,从而提供更优的抗菌效果。
传统的策略往往是将各种抗菌成分整合到一个平台(如一体化纳米材料),但这种方法存在组成复杂、可重复性低以及药代动力学不明确等挑战。因此,科学家们提出了一种新的研究思路——一体化小分子(One-for-All Small Molecules),该类分子相较于一体化纳米材料,具有更高的生物相容性、更简单的合成过程、更明确的分子结构以及更优的可重复性。
**研究内容
光激活Mn-CORM的合成及特性
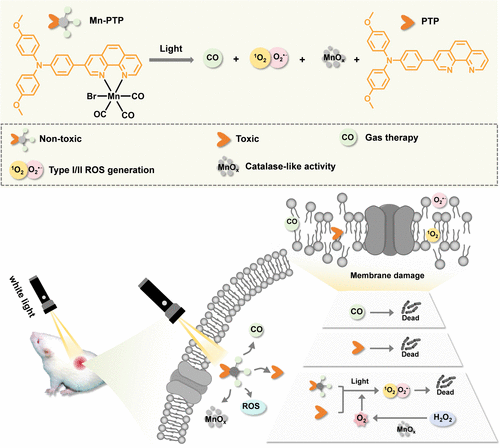
本研究成功合成了一种三羰基锰(I)络合物(Mn-PTP),用于抗结核病菌感染的协同治疗。Mn-PTP在白光照射下能够产生多种活性物质,包括:
- 活性氧(ROS):包括单线态氧(¹O₂) 和 超氧阴离子(O₂•⁻),可有效杀灭细菌;
- 一氧化碳(CO):能够通过与血红蛋白结合阻断细菌呼吸作用;
- 具有类过氧化氢酶活性的锰氧化物(MnOₓ):可以催化H₂O₂分解产生O₂,改善细菌微环境并促进ROS生成;
- 有毒性配体PTP:在光照后释放,可直接破坏细菌结构。
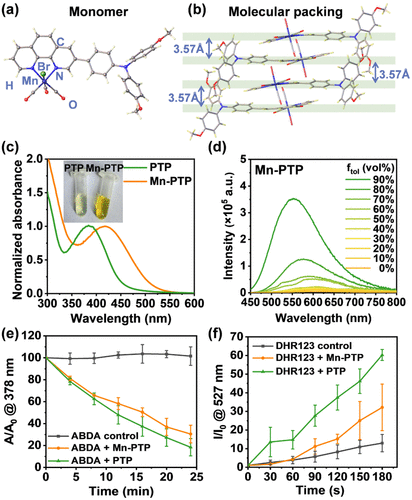
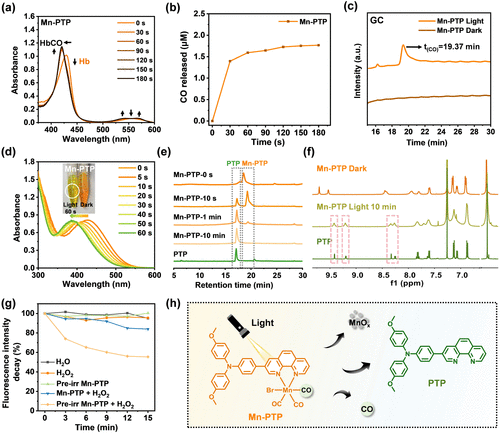
此外,Mn-PTP在暗环境中表现出良好的稳定性,仅在光照后释放活性成分,从而避免了非特异性毒性,提高了治疗的精准性。
抗菌实验:针对不同细菌的杀菌能力
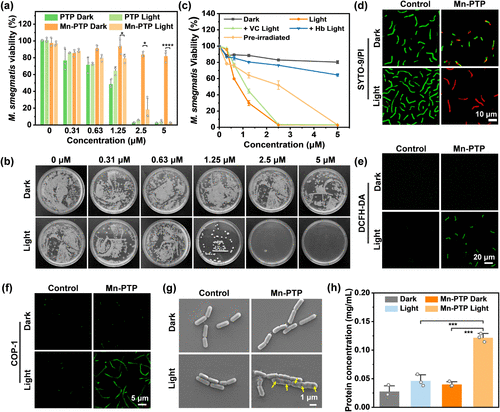
实验发现,Mn-PTP在光照下对**光滑分枝杆菌(M. smegmatis)**表现出特异性抗菌效果。研究显示:
- Mn-PTP对M. smegmatis的最小抑菌浓度(MIC90)仅为3.11 μM;
- Mn-PTP在低剂量下仍能有效破坏M. smegmatis生物膜;
- 通过扫描电子显微镜(SEM)观察,Mn-PTP+光照处理的菌株表现出严重的膜损伤和变形;
- 活死染色实验(SYTO-9/PI)显示,Mn-PTP+光照组的细菌几乎全部死亡。
此外,研究者对不同类型的细菌进行了筛选,发现Mn-PTP在光照下对革兰氏阳性菌(如表皮葡萄球菌和金黄色葡萄球菌)具有一定抑菌作用,但对革兰氏阴性菌(如大肠杆菌、肺炎克雷伯菌等)则几乎没有杀菌活性。这一现象可能与革兰氏阴性菌的细胞膜结构有关,其外膜可以有效阻挡Mn-PTP的进入。
体外及体内实验:生物膜清除及伤口愈合
结核菌感染通常伴随生物膜形成,这极大增强了其耐药性。因此,该研究进一步探讨了Mn-PTP在光照下对生物膜的清除能力。实验发现:
- Mn-PTP+光照后,结核菌生物膜的存活率下降了42.89%;
- SYTO-9/PI染色实验显示,Mn-PTP+光照显著破坏生物膜结构;
- SEM观察表明,在Mn-PTP+光照组,生物膜细胞结构严重受损,表现出细胞破裂和畸形。
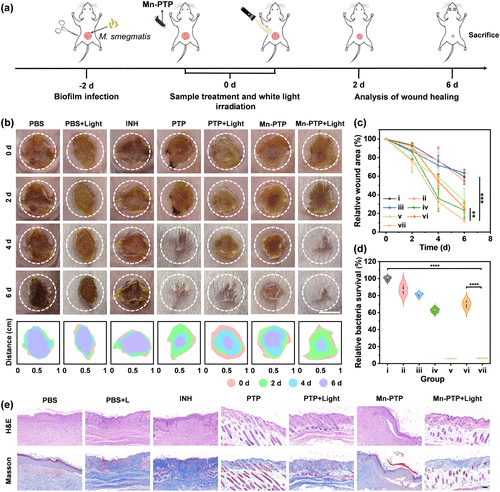
此外,研究者构建了小鼠伤口感染模型,以进一步验证Mn-PTP的治疗效果:
- 伤口感染实验:
- 先在小鼠背部制造人工创伤,并用M. smegmatis感染;
- 两天后观察感染情况,并对比不同治疗组(PBS对照组、异烟肼治疗组、Mn-PTP+光照组等)。
- 治疗效果:
- 第六天时,Mn-PTP+光照组的伤口愈合率高达87.66%;
- 对比其他治疗组,Mn-PTP+光照的抑菌效果显著高于异烟肼(INH),并且大幅降低了伤口内细菌数量。
. 
研究意义与展望
本研究首次开发了一体化光激活Mn-CORMs,为耐药结核病菌感染的治疗提供了创新型解决方案。相比传统抗菌治疗,Mn-PTP具有以下突出优势:
- 协同治疗:集光动力疗法(ROS)、CO气体疗法及生物催化等多种机制于一体;
- 高度选择性:仅在光照下释放活性成分,降低非特异性毒性;
- 良好生物安全性:实验显示Mn-PTP在暗环境下对正常细胞无害;
- 促进伤口愈合:不仅可抑菌,还能改善伤口微环境,加速组织修复。
未来,该研究可进一步优化分子结构,提高杀菌效率,同时探索其在更多耐药病原体中的应用,如耐药金黄色葡萄球菌或其他慢性感染病菌。此外,结合光纤、纳米载体等技术,Mn-CORMs或可发展成为更精准、更高效的抗菌治疗方法,为临床应用提供新思路。
参考文献
Lai, Y.; Wang, L.; Ma, H.; Chen, Z.; Wu, H.; Wen, G.; Wu, X.; Yu, B.; Li, D.; Yuan, G.; Huang, H.; Zhang, P. One-for-All Photoactivatable Manganese-Based Carbon Monoxide-Releasing Molecules (CORMs) for Synergistic Therapy of Mycobacterial Infection. J. Am. Chem. Soc. 2025, jacs.5c05490. https://doi.org/10.1021/jacs.5c05490.