【JACS】磁场增强光动力治疗:氧自由基产量提升 66.9% ,抗肿瘤效能显著提高
近年来,光动力治疗(PDT)已在皮肤病学、肿瘤学等多个领域取得显著进展,其因非侵入性、高时空选择性及低耐药性而备受关注。然而,提升光敏化效率仍是当前PDT研究中的关键挑战。传统光敏剂(PSs)在光照后会产生细胞毒性活性氧(ROS),但某些PSs的系间窜跃(ISC)效率较低,限制了抗肿瘤效能。本研究提出了一种磁场增强光动力治疗(Magneto-PDT)策略,利用氟苯取代的五甲川菁染料(Cy5–3,4,5–3F)作为新型光敏剂,借助磁场效应放大其氧自由基的生成能力,显著提升抗肿瘤治疗效果。
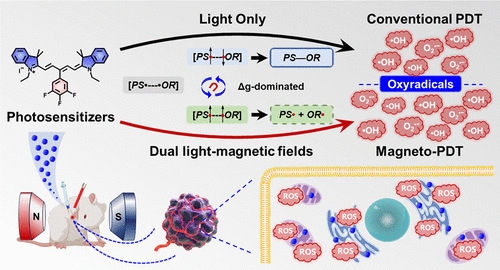
光敏化机制与磁场调控
研究发现,Cy5–3,4,5–3F光敏化过程中形成了一对磁感应活性自由基(RP)中间体,由于光敏剂与氧自由基之间的g因子差异(Δg),磁场可促进其自旋混合,从而提高羟基自由基(•OH)和超氧阴离子自由基(O₂•⁻)的生成效率。在500毫特斯拉(mT)磁场作用下,•OH产率提升了66.9%,O₂•⁻产率提升了28.0%,展现出强大的磁场放大效果。这一效应显著增强了光动力治疗的细胞毒性,使得小鼠乳腺癌4T1细胞的半抑制浓度(IC50)在常氧条件下从0.91 μM(PDT单独治疗)降至0.38 μM(Magneto-PDT),呈现出卓越的抗肿瘤能力。
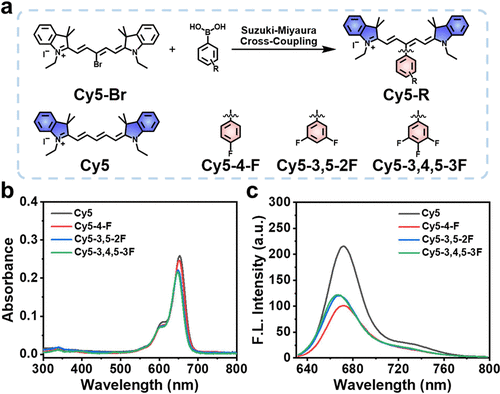
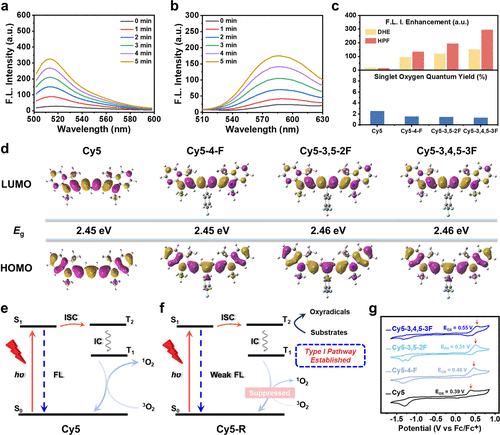
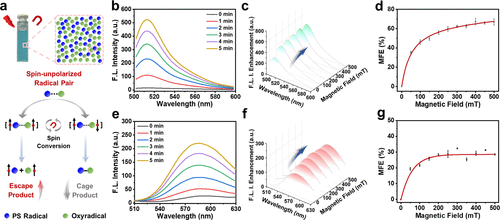
细胞实验验证
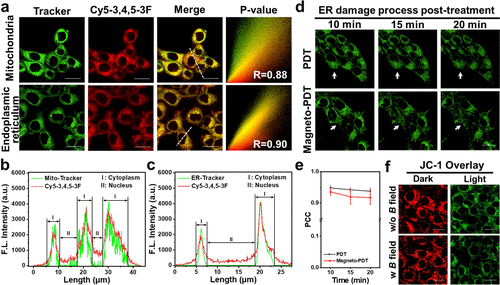
研究进一步在多种肿瘤细胞模型(4T1、HepG2、MCF-7)中验证了该策略的普适性。Cy5–3,4,5–3F进入细胞后会快速积聚于线粒体和内质网(ER),表现出双重靶向性。在磁场光照联合处理下,•OH和O₂•⁻产生量较单光照增加了1.82倍和1.20倍,导致细胞快速凋亡。实验显示,Cy5–3,4,5–3F仅在光照激活后产生杀伤作用,具有极低的暗毒性,有望作为精准抗肿瘤治疗的新型光敏剂。
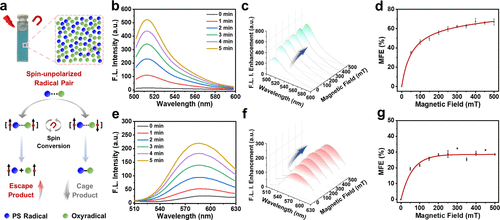
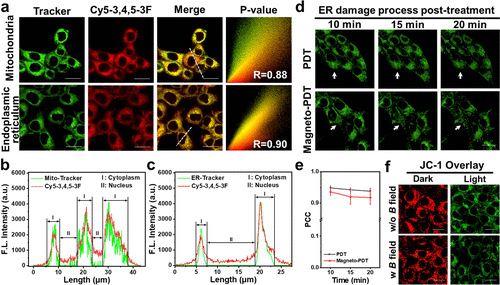
体内抗肿瘤评估
在小鼠乳腺癌模型中,研究进一步评估了Magneto-PDT的抗肿瘤能力。实验结果表明,仅单独使用光照或磁场的治疗组未能有效抑制肿瘤,而PDT单独治疗虽能暂时抑制肿瘤增长,但10天后肿瘤开始复发。相较之下,Magneto-PDT组的肿瘤抑制效果更为显著,14天内实现完全清除,且小鼠体重保持稳定,无明显副作用。病理分析显示,该方法可有效减少肺部转移风险,同时确保心脏、肝脏、脾脏及肾脏的组织完整性,证明其在生物安全性上的可行性。
结论
本研究首次实现了磁场调控光动力治疗的抗肿瘤效能放大,提出了一种基于自旋演化调控的创新PDT策略。通过磁场增强氧自由基生成,该方法成功降低了光敏剂的使用浓度,提高了治疗效率,并在体内外实验中展现出优异的抗肿瘤效果。该研究为光动力治疗领域提供了新思路,有望推动肿瘤治疗技术的发展,提升数字化精准医疗的应用水平。未来,该策略可进
参考文献
Lu, J.; Ding, J.; Xia, Z.; Yang, Z.; Lv, C.; Zong, S.; Cao, J.; Zhou, D.; Long, S.; Sun, W.; Du, J.; Fan, J.; Peng, X. Spin Manipulation Engineering of Photodynamic Intermediates: Magnetic Amplification of Oxyradicals Generation for Enhanced Antitumor Phototherapeutic Efficacy. J. Am. Chem. Soc. 2025, 147 (21), 18100–18109. https://doi.org/10.1021/jacs.5c04111.