【JACS】突破极限:200%提升抗癌疗效的熊果酸纳米平台
研究背景
癌症仍是全球范围内的重大公共健康挑战,位居全球致死原因的第二位,其死亡率持续上升。癌症微环境(TME)呈现出独特特征,如轻度酸性、氧化还原稳态受损、酶的过度表达以及缺氧等,这些特点与正常组织不同,因此为纳米药物的发展提供了重要启示。近年来,“原位自组装”策略成为纳米医学领域的一种创新方法,可以在肿瘤微环境中直接构建复杂的材料,从而提高纳米药物的药代动力学特性,改善深度肿瘤组织的渗透能力,减少药物耐受性,并促进细胞器的靶向,提高治疗效果。
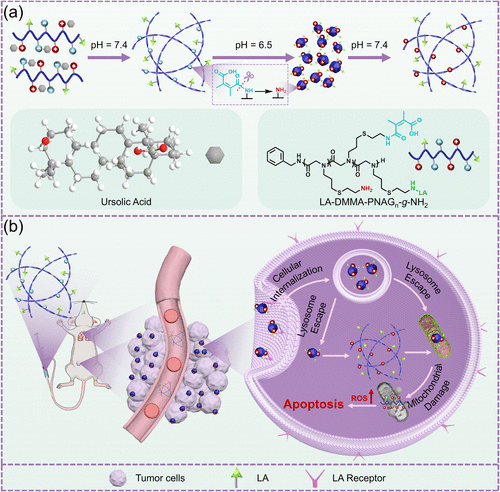
五环三萜类天然化合物因其丰富的生物活性在抗癌治疗领域具有很高的潜力。其中,熊果酸(UA)作为一种具有生物活性的五环三萜类化合物,能够靶向关键肿瘤信号通路,抑制转移、抑制增殖并诱导凋亡。然而,其临床应用受到溶解性和生物利用度低的限制,为此,科学家开发了多种熊果酸衍生物来提高其治疗效果。但目前在合成复杂性、靶向特异性以及精准原位自组装方面仍面临挑战。
研究核心
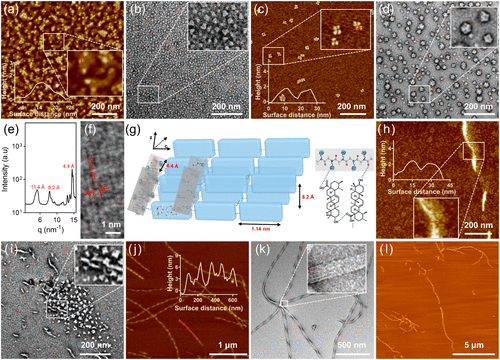
本研究提出了一种蛋白模拟的聚肽类组装辅因子辅助熊果酸的纳米平台,旨在提高熊果酸的抗癌活性。在此方案中,研究人员利用生物活性聚肽类聚电解质作为组装辅因子,引导熊果酸形成pH响应性纳米结构。这些聚肽类辅因子通过精确控制自组装过程,提高稳定性,并实现可逆的pH响应性转变。
创新点与突破
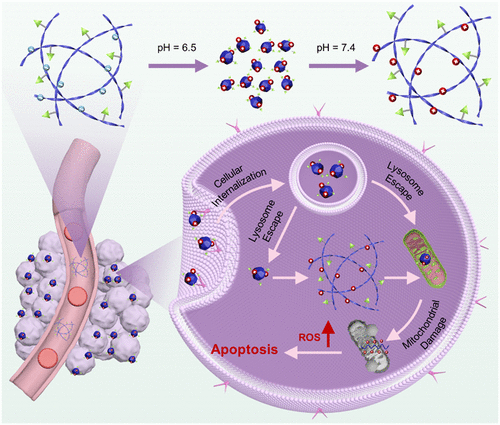
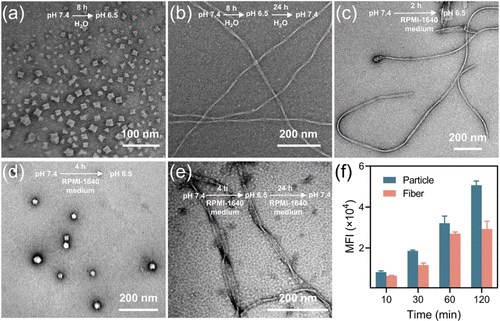
- 酸响应性调控:在中性条件下,熊果酸纳米结构保持螺旋状纤维结构,而在酸性肿瘤微环境中,则可转化为病毒状纳米簇,促进更深层次的肿瘤渗透。
- 靶向机制:利用乳果糖酸(LA)进一步增强靶向性,使纳米结构能够选择性地进入肿瘤细胞内部,提高药物递送效率。
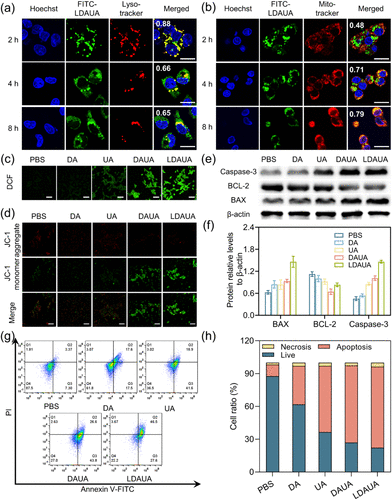
- 细胞器靶向:该纳米平台在细胞内被摄取后,能够逃逸至胞质,并累积在线粒体周围,通过氧化硫醚键触发熊果酸和聚肽类的释放,造成线粒体损伤并诱导细胞凋亡。
- 长效治疗:部分纳米颗粒在细胞内部重新组装为纤维结构,延长其在肿瘤细胞内的滞留时间,进一步增强线粒体损害效应。
实验结果
在小鼠体内研究进一步验证了该策略的有效性,结果表明:
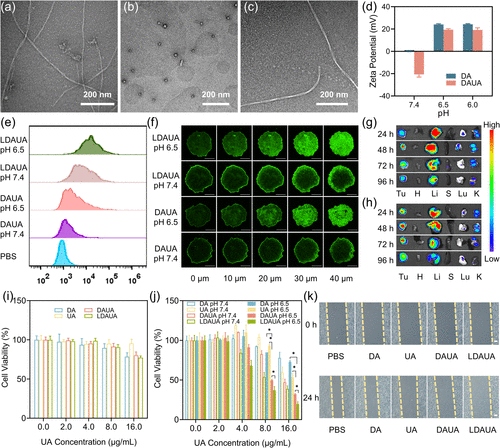
- 该纳米平台在体内展现出200%以上的癌细胞抑制率,远高于单独使用熊果酸或聚肽类的效果。
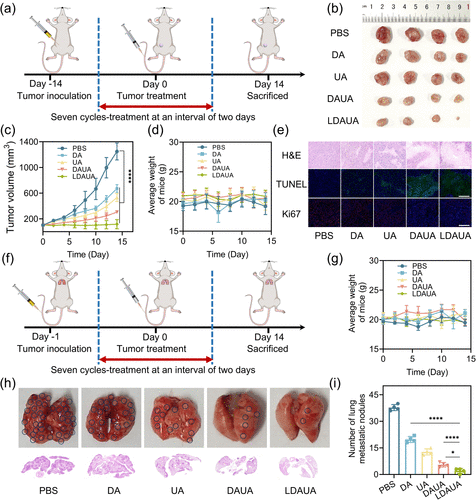
- 通过精准靶向和深度渗透机制,显著减少肿瘤生长,并降低癌细胞的转移能力。
- 在肿瘤微环境中,该纳米平台展现出卓越的协同效应,较传统纳米载体具有明显的治疗优势。
此外,细胞实验表明,在酸性条件下,该纳米平台能显著增强细胞摄取率,提高深度肿瘤组织渗透能力,从而提高整体治疗效率。
结论
通过整合生物活性聚肽类辅因子与熊果酸,该协同纳米平台代表了一种高效的癌症治疗新策略,为天然化合物在先进纳米医学中的应用提供了新的可能性。该研究不仅优化了熊果酸的药物递送方式,还通过病毒状纳米簇自组装、细胞器靶向及pH响应性调控,实现了癌症治疗的重大突破。这一成果或将成为下一代抗癌纳米药物的核心技术,极大提高熊果酸的临床转化潜力,为未来的癌症治疗提供创新方向。
参考文献
Lin, M.; Liu, D.; Gong, Y.; Shu, L.; Wang, H.; Zhang, G.; Li, J.; Gao, Z.; Sun, J.; Chen, X. Bioactive Assembly Cofactor-Assisted Ursolic Acid Helix for Enhanced Anticancer Efficacy via In Situ Virus-like Transition. J. Am. Chem. Soc. 2025, 147 (20), 17010–17021. https://doi.org/10.1021/jacs.5c01214.