【JACS】光控超分子作用调节钾离子跨膜运输及其诱导癌细胞凋亡的研究
简介
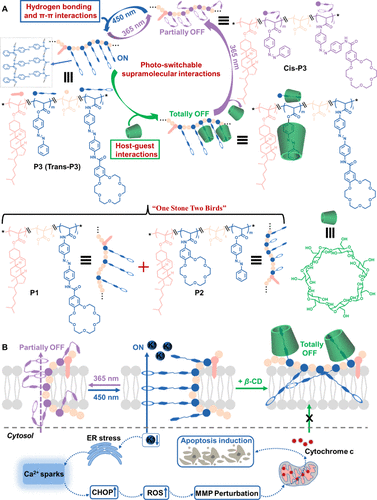
本研究开发了一种基于单链随机异质聚合物(RHPs)的光控人工钾离子通道(P3),通过调整其超分子作用(如氢键作用、π–π作用及主客体作用)实现离子运输状态的可控性。此系统在模拟自然通道蛋白机制方面展现了潜力,并为癌症治疗提供了新思路。 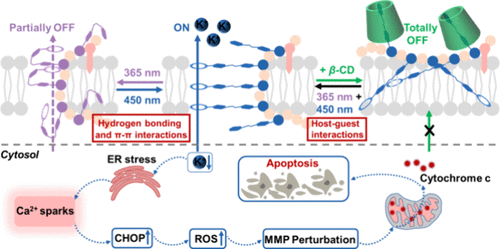
摘要
研究通过结合偶氮苯光异构体设计的RHPs构建光控钾离子通道P3,可调控三种离子运输状态(“开”、“部分关闭”和“完全关闭”)。研究发现,光刺激导致的钾离子外流引发内质网(ER)应激,产生活性氧(ROS),降低线粒体膜电位(MMP),最终导致线粒体依赖的细胞凋亡。P3展示了高效的钾离子运输能力及显著的抗癌潜力,为人工离子通道的研究和应用开辟了新途径。
研究结果与讨论
1. 设计与合成
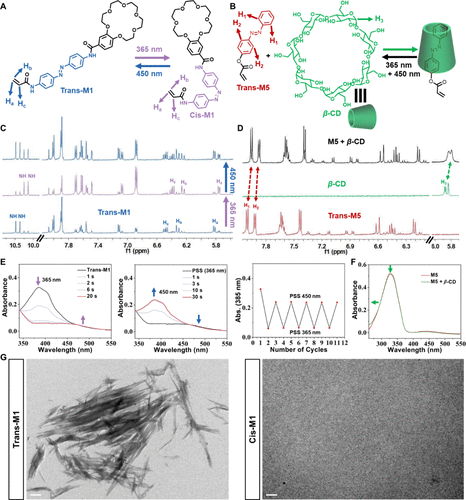
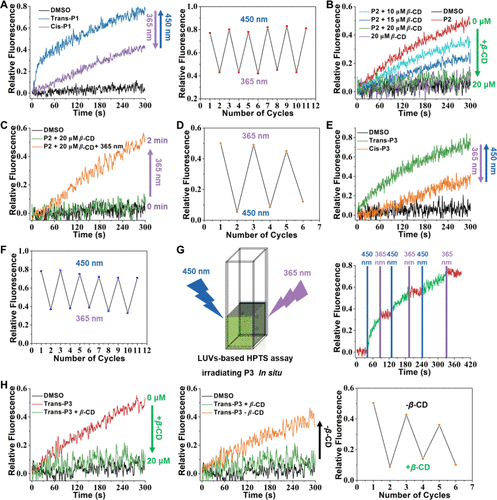
- 通过RAFT共聚合成包含偶氮苯基团的异质聚合物P3,验证其超分子作用(包括氢键与π-π相互作用)对钾离子通道功能的调控。
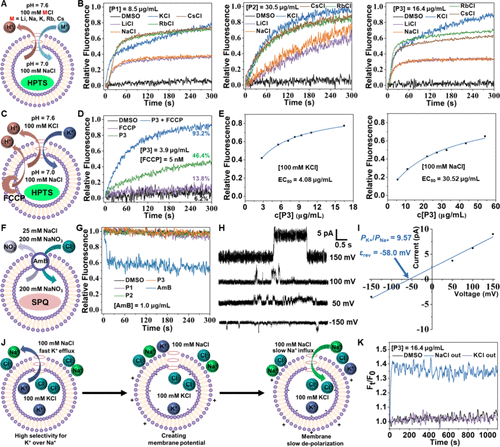
2. 运输能力与选择性
- 实验表明,P3在脂质体模型中表现出优越的钾离子运输选择性(K+/Na+比值高达9.57)及膜电位产生能力,而对Cl-和H+无显著影响。
1. 光响应与主客体作用
- 通过光诱导偶氮苯基团的顺反异构化以及与β-环糊精(β-CD)的复合,实现运输状态在“开”、“部分关闭”和“完全关闭”之间的切换。
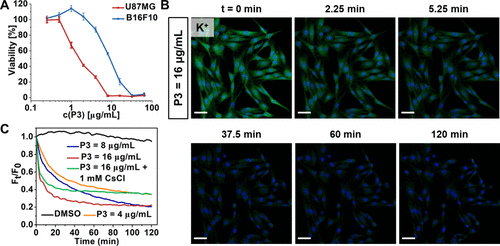
1. 对癌细胞的作用
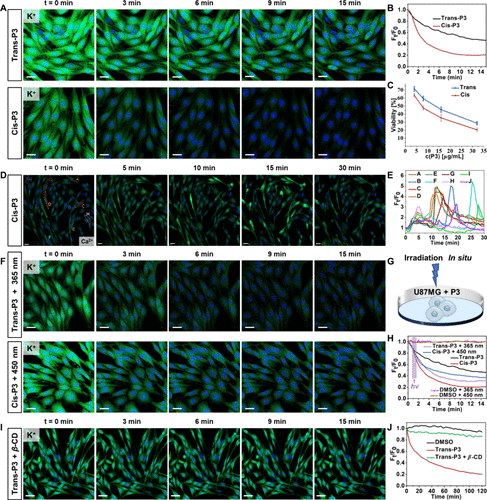
P3处理导致癌细胞内钾离子显著外流(4分钟内减少50%),通过内质网应激和线粒体功能障碍引发细胞凋亡。
流式细胞术、免疫荧光等验证其促进早期与晚期凋亡比例显著增加。
结论
P3作为一种高效光控钾离子通道,展现出模拟自然通道蛋白的多态性及抗癌治疗的应用潜力。研究揭示了钾离子外流及细胞凋亡之间的关联,为开发新型抗癌策略提供了可能。
参考文献
Li, C.; Wu, Y.; Bao, S.; Li, H.; Xu, Z.; Yan, J.; Yu, X.; He, L.; Zhang, T.; Liu, W.; Hou, S.; Zhang, Y.; Xu, J.; Yan, T.; Wang, T.; Yan, Y.; Liu, J. Photo-Switchable Supramolecular Interactions Regulate K+ Transmembrane Transport and Cancer Cell Apoptosis. J. Am. Chem. Soc. 2025, jacs.4c14583. https://doi.org/10.1021/jacs.4c14583.