【Adv.Mater.】纳米酶革命:8-10 原子厚高熵催化体系提升 70°C 光热治疗效果
近年来,纳米酶在生物医学领域的研究发展迅猛,尤其是在疾病治疗方面表现出巨大潜力。本文介绍了一项突破性的研究,成功构建了一种原子级高熵纳米酶(High-Entropy Nanozyme, HEAzyme)体系,不仅实现了卓越的内源靶向催化,还显著增强了肿瘤的光热治疗效果。这项工作为纳米酶学研究提供了全新的思路,并在临床应用方面展现了广阔的前景。
1. 纳米酶的背景与发展
纳米酶(Nanozyme)自2007年被首次报道以来,受到了广泛关注,并已发展出数千种不同类型的纳米酶。其具有以下特点:
- 低成本,相比天然酶更加经济可控;
- 高稳定性,适用于多种复杂环境;
- 可规模化生产,易于工业化应用;
- 催化活性可调节,适应不同生物环境。
尤其在医学领域,纳米酶被广泛应用于肿瘤治疗、炎症控制、神经退行性疾病防治(如阿尔茨海默病)、心血管疾病改善等。其核心机制主要包括:
- 清除活性氧(ROS)——帮助减轻细胞氧化损伤;
- 通过催化内源环境生成ROS——提高肿瘤杀伤效率。
然而,目前纳米酶的催化效率仍存在较大挑战,急需开发新型、多功能、高效的纳米酶系统,以进一步提升其生物医学应用能力。
2. 高熵合金与原子级纳米酶的构建
高熵合金(High-Entropy Alloy, HEA)是一类新型金属材料,由五种或更多金属元素组成。这类合金材料因其高混合熵效应、晶格畸变效应、动力学缓慢扩散效应等特点,表现出特殊的物理化学性能。在纳米催化领域,高熵合金催化剂因其低超电势、高稳定性和快速动力学性质,展现出巨大应用潜力。
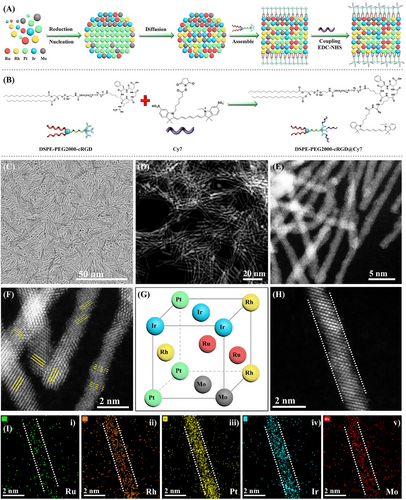
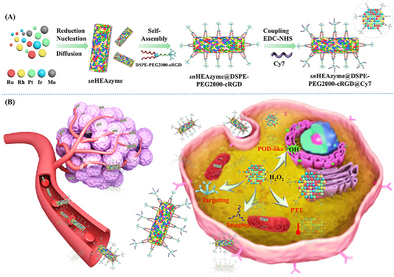
本研究首次成功合成了一种 RuRhPtIrMo 亚纳米高熵纳米酶(sn HEAzyme),其平均宽度仅为 8–10 个原子。研究团队采用 还原扩散法(Reduction-Diffusion) 和 表面修饰技术(Grafting) 构建了这种纳米酶体系。具体制备过程包括:
- 选择五种金属前驱体(Ru、Rh、Pt、Ir、Mo) 作为原材料;
- 通过还原扩散技术控制金属原子的均匀分布,形成稳定的单相固溶纳米棒结构;
- 采用细胞靶向分子 DSPE-PEG2000-cRGD 和荧光成像分子 Cy7 修饰纳米酶表面;
- 最终得到稳定的 sn HEAzyme@DSPE-PEG2000-cRGD@Cy7 纳米酶系统。
此体系不仅展现出高效的过氧化物酶(Peroxidase, POD)类催化活性,还能够显著增强近红外(NIR)光热效应,为肿瘤治疗提供了新的可能性。
3. 纳米酶的催化活性及光热转换效果
本研究系统地评估了 sn HEAzyme@DSPE-PEG2000-cRGD@Cy7 的催化活性和光热转换效果,实验结果表明:
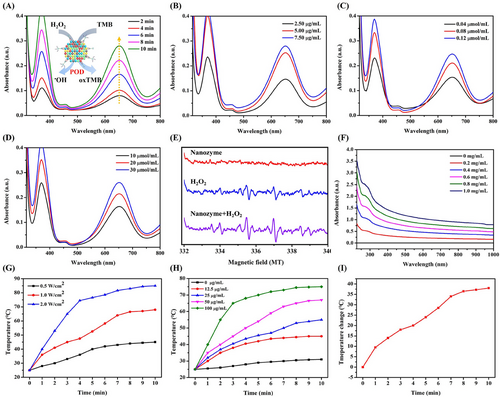
- 该纳米酶具有卓越的 POD 类催化活性,可有效分解过氧化氢(H₂O₂)并生成毒性极高的羟自由基(•OH),用于杀伤肿瘤细胞;
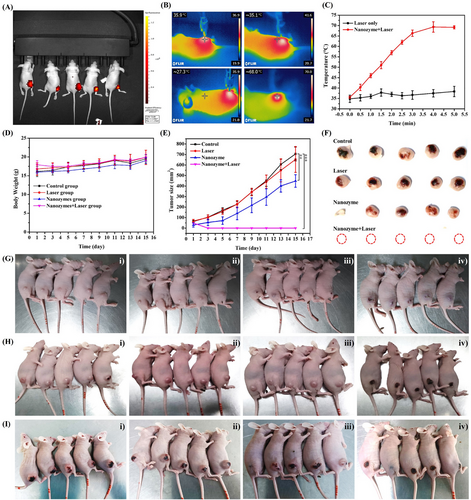
- 在近红外照射(808 nm)下,纳米酶展现出良好的光热转换效应:
- 激光功率 2 W/cm² 时,溶液温度可迅速升高至 80°C;
- 激光功率 1 W/cm² 时,溶液温度可达 60°C;
- 纳米酶浓度 50 µg/mL 时,温度提升可达 40°C。
这一光热转换特性使纳米酶能够精准调控肿瘤微环境,在治疗过程中产生协同热效应,促进肿瘤细胞凋亡。
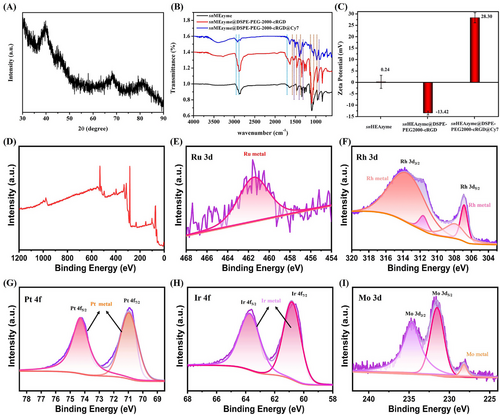
此外,研究还采用电子顺磁共振(EPR)技术对催化机制进行了深入探讨,证实纳米酶能够高效催化 H₂O₂ 的分解,并生成强氧化性的 •OH,进一步增强其抗肿瘤效能。
4. 计算模拟与催化机制
为了深入理解纳米酶的催化机制,研究团队使用 密度泛函理论(DFT) 进行计算模拟,探索不同金属组合对催化活性的影响。计算结果表明:
- RuRhPtIrMo 纳米酶的 H₂O₂ 吸附能最低(-0.72 eV),具有最稳定的吸附结构;
- 在催化反应路径中,RuRhPtIrMo 展现出最优的电子云密度分布,其费米能级附近的电子态密度最高;
- 相较于其他高熵纳米酶,RuRhPtIrMo 体系的自由能变化最大,具有最强的催化动力学优势。
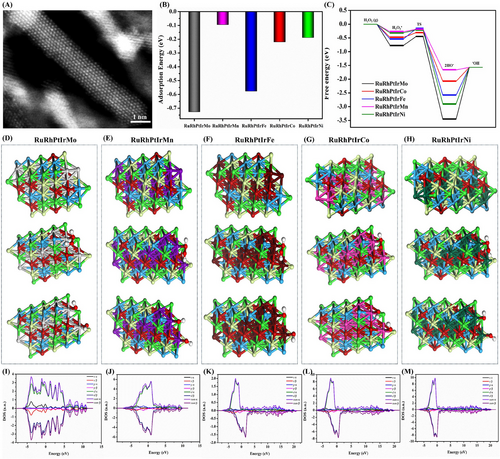
这些计算结果进一步支持了实验数据,说明 RuRhPtIrMo 体系在纳米酶学研究中具有重要应用价值。
5. 稳定性与生物医学应用
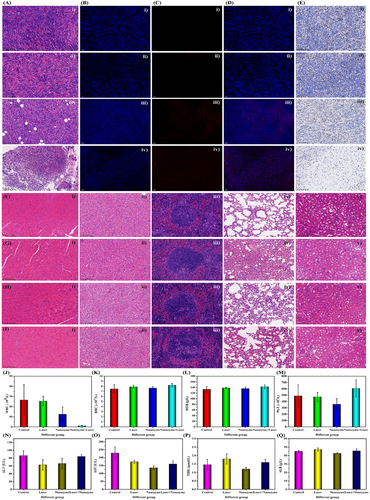
为了评估纳米酶的稳定性,研究团队进行了长时间存储与多次重复使用实验,结果显示:
- 存储半年后,纳米酶的催化活性未发生明显变化;
- 经过 6 次重复使用,纳米酶仍然保持高活性;
- 纳米酶的形貌在透射电镜(TEM)表征下未出现显著变化。
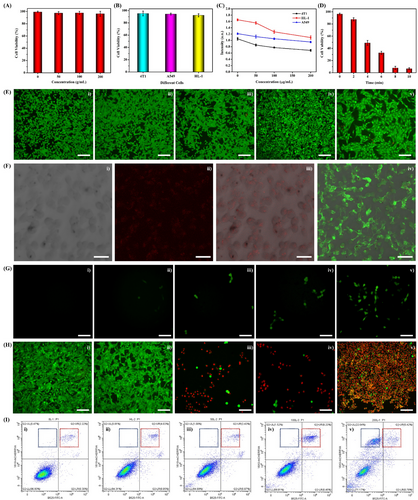
此外,在生物医学实验中,该纳米酶体系展现出良好的生物相容性,并能够精准靶向肿瘤组织,实现高效的光热治疗效果。在 4T1 乳腺癌细胞模型实验中,细胞毒性检测结果表明:
- 纳米酶浓度低于 200 µg/mL 时,对正常细胞无明显毒性;
- 在肿瘤微环境中,该纳米酶能够有效穿透细胞膜,促进肿瘤细胞死亡。
6. 未来展望
这项研究成功开发了一种 原子级高熵纳米酶体系,不仅突破了纳米酶催化效率的瓶颈,还实现了精准的肿瘤光热治疗。未来,该技术有望进一步优化:
- 纳米酶的合成工艺,提高催化活性与稳定性;
- 在其他疾病治疗中的应用,如神经系统疾病、抗菌治疗等;
- 结合智能靶向策略,提升纳米酶的临床转化潜力。
这一创新性的研究为纳米酶学和肿瘤治疗带来了新的突破,也为未来的精准医学发展奠定了坚实的基础。
参考文献
Ai, Y.; Wang, Z.; Shi, W.; Jia, X.; Cui, M.; Sun, H.; Ren, F.; He, M.; Liang, Q. Atomic‐Level High‐Entropy Nanozymes Enable Remarkable Endogenous Targeted Catalysis and Enhancing Tumor Photothermal Therapy. Advanced Materials 2025, 2502322. https://doi.org/10.1002/adma.202502322.