【JACS】信噪比高达4000:1,新型近红外阿尔茨海默病淀粉样蛋白聚集的实时追踪荧光探针
这篇文章探讨了一种能够敏感检测整个淀粉样β蛋白(Aβ42)聚集路径的近红外溶致变色荧光探针(Phazr-N3),其在阿尔茨海默病(AD)研究中的潜在应用。该荧光探针通过环境敏感的光谱变化,自最初的纳米级寡聚体到最终形成大规模斑块的过程中,对Aβ42聚集进行实时追踪。研究展示了Phazr-N3能够在无洗涤条件下,以极高信号背景比(>4000:1)标记合成斑块,并且能够检测出标准淀粉样荧光染料ThT无法观测到的结构细节。这为研究Aβ42聚集的早期事件以及其与神经退行性疾病的关系提供了新的工具。
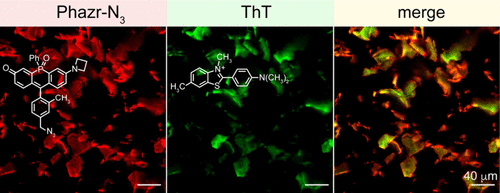
背景与研究目的
阿尔茨海默病(AD)是一种神经退行性疾病,其特征之一是Aβ42蛋白的聚集形成大规模斑块。然而,越来越多的证据表明,真正的神经毒性因子可能是聚集路径中的可溶性纳米级寡聚体,而非最终形成的斑块。这些寡聚体的具体结构、形成机制及其如何演变成宏观斑块,仍然是科学界未解的难题。
传统的荧光探针(如ThT)主要用于检测晚期的纤维化斑块,并且通常具有较长的滞后期,无法有效捕捉聚集过程中的早期事件。因此,研究者们开发了一种近红外溶致变色荧光探针——Phazr-N3,它能够对整个Aβ42聚集路径进行非侵入性的实时监测。此探针可以在极低浓度(1 mol%)下使用,并且不会显著干扰Aβ42的聚集动力学,使其成为研究早期聚集事件的理想工具。
荧光探针Phazr-N3的设计与特点
Phazr-N3是一种磷酸氧化脒罗丹荧光分子,其采用了推-拉电子结构,并具有氮杂环丁烷功能化的磷酸氧桥,赋予其独特的溶致变色特性。在不同极性的环境中,它的发射峰会发生显著的红移或蓝移,使其成为检测蛋白聚集过程中环境变化的敏感探针。
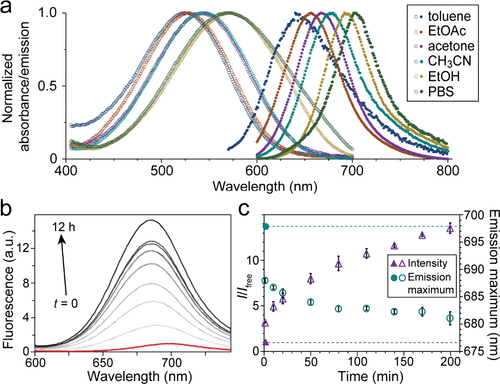
研究显示,Phazr-N3在非极性溶剂中(如甲苯)具有630 nm的荧光发射峰,而在水性缓冲液中则发生显著红移至703 nm。此外,Phazr-N3在不同溶剂中的量子产率最高可达62%,在中等极性的溶剂(如丙酮)中的荧光亮度最高。相比于传统的荧光染料,Phazr-N3具有更大的斯托克斯位移(>100 nm),更广泛的吸收光谱范围,以及更低的吸收峰消光系数,这使其在荧光成像中具有显著优势。
Phazr-N3在Aβ42聚集监测中的应用
研究团队使用Phazr-N3对合成的Aβ42蛋白进行了实时聚集监测,发现该荧光探针在聚集诱导后立即发生溶致变色变化,并在12小时内经历多个聚集阶段。相比于传统的ThT荧光探针,Phazr-N3的荧光强度变化更为稳定,并且不会受到ThT测定中的高变异性影响。
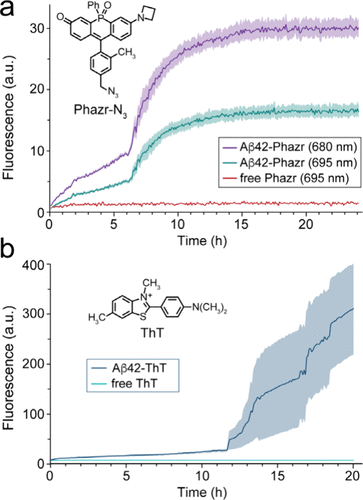
此外,研究表明,Phazr-N3对自由态Aβ42的结合亲和力达到微摩尔级,在聚集过程中能够持续检测并报告周围环境的逐步脱水过程。荧光各向异性测量显示,与Aβ42结合的Phazr-N3比单独存在时显示出更大的各向异性,表明其结合过程中发生了明显的结构变化。该探针能够以纳米级分辨率检测到Aβ42的液-液相分离现象,并揭示其聚集过程中疏水环境的变化。
荧光成像与生物应用
Phazr-N3的近红外特性使其在生物成像中具有优势,包括:
- 低光毒性:相比于紫外或可见光荧光染料,Phazr-N3的激发光不会对生物样本造成显著损害。
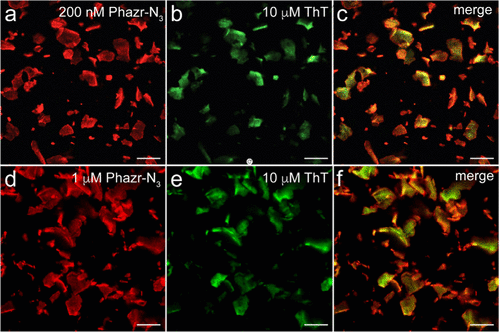
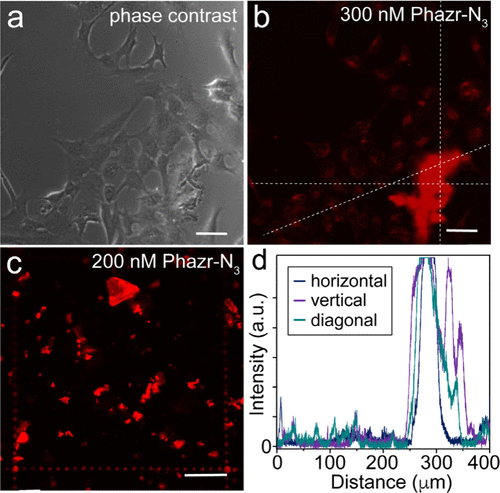
- 高信号背景比(SBR):在斑块成像中,Phazr-N3的荧光信号比背景高出4000倍以上,即使与微胶质细胞或血清蛋白共存,仍然保持高选择性结合斑块。
- 实时跟踪:在无洗涤条件下,Phazr-N3能够在合成Aβ42斑块和活细胞环境中长时间保持荧光稳定性,适用于动态监测。
未来展望
Phazr-N3的成功开发为研究Aβ42聚集的早期过程及其生物学影响打开了新窗口。未来的研究可能涉及:
- 与活细胞共培养:研究Aβ42聚集如何影响神经细胞功能,并探索微胶质细胞在斑块形成中的作用。
- 体内实时成像:利用Phazr-N3监测动物模型中Aβ42聚集的动态变化,以评估其与阿尔茨海默病发展的关系。
- 药物筛选:采用Phazr-N3对潜在的抗Aβ42聚集药物进行快速筛选,寻找可能影响聚集路径的治疗候选物。
结论
Phazr-N3作为一种溶致变色近红外荧光探针,不仅能够在极低浓度下结合自由态Aβ42,还能够全程跟踪其聚集路径,提供实时、无侵入性的聚集监测。其超高信号背景比、环境敏感性及生物兼容性,使其成为研究阿尔茨海默病机制和开发新型药物的有力工具。这项研究的突破性发现,将有助于深入理解神经退行性疾病的分子基础,并推动创新治疗方法的发展。
参考文献
Wang, Z.; Kristensen, L. G.; Ho, Y. H.; Liu, Y.; Valencia, L. A.; Nadig, I.; Range, K. L.; Rad, B.; Ralston, C. Y.; Cohen, B. E. A Solvatochromic Near Infrared Fluorophore Sensitive to the Full Amyloid Beta Aggregation Pathway. J. Am. Chem. Soc. 2025, jacs.5c01512. https://doi.org/10.1021/jacs.5c01512.