【Adv.Mater.】显著高于FDA批准的MC3 LNPs,新型mRNA递送脂质
简介
mRNA治疗在感染性疾病、癌症和遗传疾病领域备受关注。然而,高效递送mRNA至中枢神经系统(CNS)仍是重大挑战。本研究开发了一类脑靶向脂质(BLs),将其与氨基脂质结合,并与辅助脂质配制成脑靶向脂质纳米颗粒(BLNPs)。在筛选研究中,TD5 BLNPs在脊髓腔内(IT)注射后表现出优越的mRNA递送效率,显著高于FDA批准的MC3 LNPs。本研究展示了该递送系统在基因编辑和CNS疾病治疗中的潜力。
摘要
本研究开发了脑靶向脂质纳米颗粒(BLNPs),用于提高mRNA在CNS中的递送效率。筛选结果显示,TD5 BLNPs在单次IT注射后,在29.6%的神经元和38.1%的星形胶质细胞中诱导GFP表达。此外,在Ai14小鼠模型中,TD5 BLNPs携带的Cre重组酶mRNA在≈30%的神经元和40%的星形胶质细胞中诱导tdTomato表达,表明其高效基因编辑能力。同时,该递送系统在Cas9 mRNA/sgRNA复合体的递送中表现出有效的基因组编辑能力,且安全性与MC3 LNPs相当。该研究证明了TD5 BLNPs作为CNS治疗策略的潜力。
研究结果与讨论
脂质纳米颗粒的设计与优化
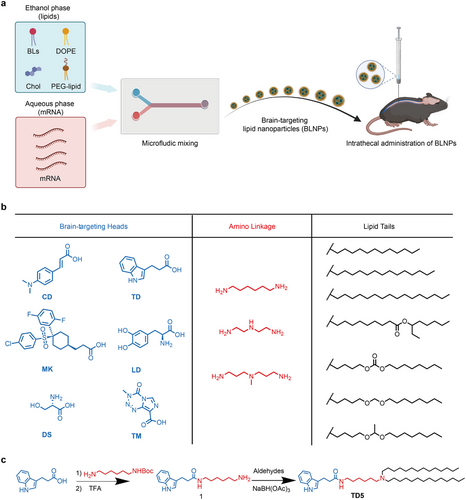
研究团队开发了六类脑靶向脂质(BLs),结合脑靶向小分子以增强mRNA递送。通过化学合成,将不同脂质尾部结构与氨基脂质结合,构建出TD5 BLNPs。
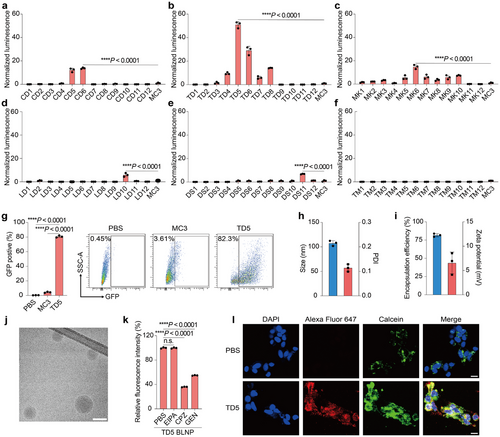
体外mRNA递送能力评估
在神经母细胞瘤SH-SY5Y细胞模型中,TD5 BLNPs的mRNA递送效率比MC3 LNPs高出50倍。此外,80.8%的细胞在TD5 BLNP-GFP mRNA处理后表达GFP,而MC3 LNPs仅诱导4.4%的细胞表达GFP。
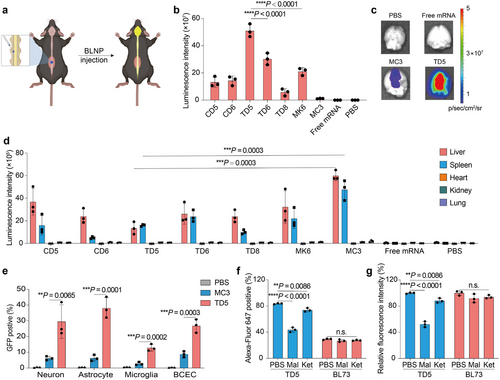
脑靶向能力验证
IT注射后,TD5 BLNP-FLuc mRNA在脑组织中的荧光信号比MC3 LNPs高出42倍,表现出显著的脑靶向能力。此外,该递送系统在神经元(29.6%)、星形胶质细胞(38.1%)、小胶质细胞(12.9%)和脑毛细血管内皮细胞(26.9%)中均有效递送mRNA,显示其广泛的细胞适用性。
5-HT受体介导的细胞摄取机制
研究发现,TD5 BLNPs主要通过5-HT1A受体介导的内吞作用进入星形胶质细胞,而5-HT2A受体则在较小程度上影响其摄取。这一机制表明,TD5 BLNPs的色胺结构有助于提高递送效率。
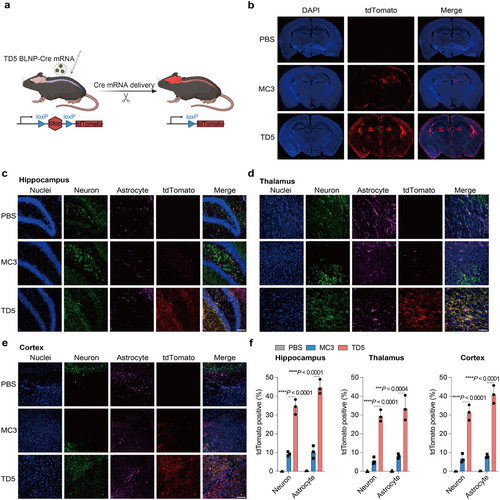
mRNA基因编辑与治疗应用
TD5 BLNPs在Ai14小鼠脑组织中成功递送Cre重组酶mRNA,诱导tdTomato表达,表明其在基因编辑中的应用前景。此外,TD5 BLNPs携带Cas9 mRNA/sgRNA复合体实现高效基因组编辑,且在肝脏和脾脏中几乎无脱靶效应,进一步确认其安全性。
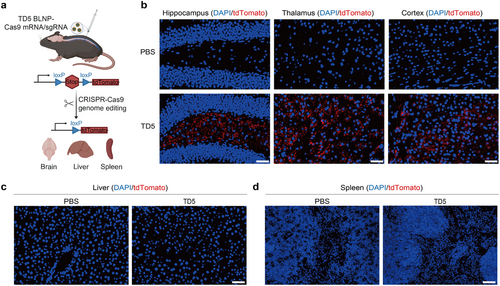
生物相容性和安全性评估
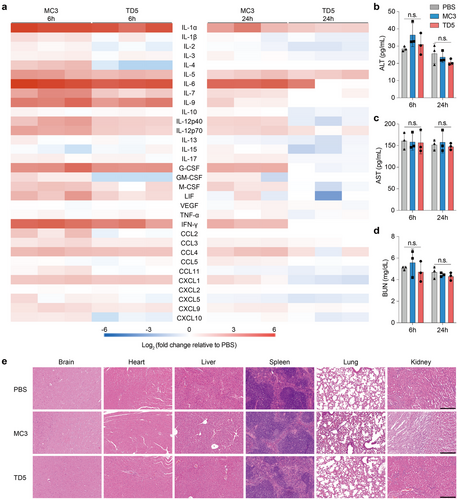
TD5 BLNPs引发的炎症反应比MC3 LNPs更低,关键炎症标志物水平在24小时内恢复至基线。此外,其对肝肾功能无显著影响,组织病理学检查未发现明显毒性,证明该系统具有良好的安全性。
结论
TD5 BLNPs表现出高效的mRNA递送能力、安全性及基因编辑效率,是未来CNS疾病治疗的潜在工具。其脑靶向设计、广泛的细胞递送能力以及低毒性特点,使其成为神经疾病干预的理想选择。该研究为CNS治疗提供了新的策略,尤其是在神经退行性疾病和基因编辑治疗方面具有重要意义。