【Angew】NIR光触发的级联纳米系统:时空控制基因沉默和气体协同癌症治疗的突破
总结
研究开发了一种NIR光触发的级联纳米系统,通过NIR诱导NO释放,实现了APE1重定位,从而增强了基因沉默的效率和时空可控性。该策略在体内外实验中表现出显著的抗肿瘤效果。
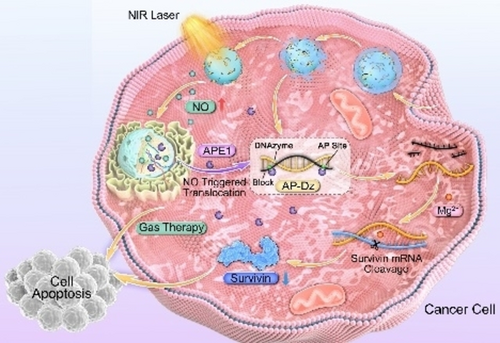
摘要
尽管DNA酶在基因治疗中具有巨大潜力,但实现高效的时空基因调控仍是一个关键挑战。本研究开发了一种NIR光触发的级联效应系统,能够实现精确的时空基因沉默和气体协同癌症治疗。该纳米平台由酶激活的DNA酶、NO前体和上转换纳米颗粒(UCNPs)构建。UCNPs作为光转换器,在NIR光照射下促进前体产生NO,生成的NO不仅直接参与气体治疗,还诱导细胞质中APE1水平的上调,从而增强DNA酶的激活和基因沉默的空间控制。通过利用这一机制,NIR光控制的NO释放和APE1激活的基因治疗相结合,实现了级联效应介导的气体-基因协同治疗。研究表明,该纳米平台在体内外实验中均表现出显著的抗肿瘤效果。这一策略代表了向高度靶向和高效癌症治疗迈出的关键一步。
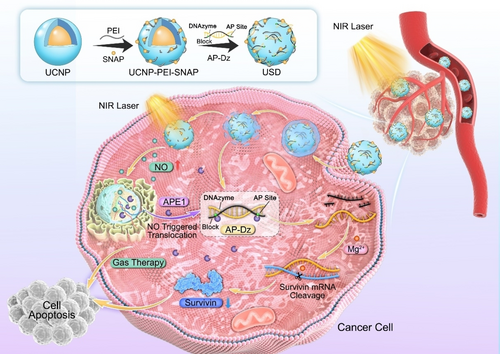
研究结果分类展示
纳米平台的合成与表征
- 合成方法:通过热分解法合成NaGdF4:Yb,Tm@NaGdF4核壳UCNPs,并用PEI修饰表面以提高水溶性和NO供体及DNA的负载效率。
- 表征方法:利用透射电子显微镜(TEM)、傅里叶变换红外光谱(FT-IR)和紫外-可见光谱(UV-Vis)对纳米颗粒进行表征,确认其结构和尺寸。
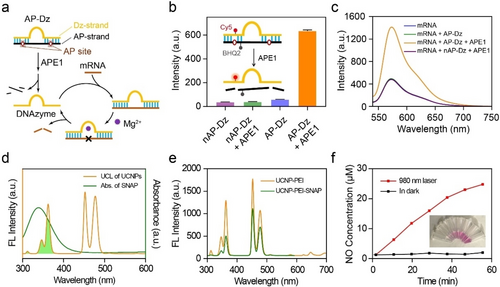
光物理性质
- 吸收和发射光谱:UCNPs在980 nm激光照射下表现出350、365、455和479 nm的特征上转换发光(UCL)带。
- NO释放效率:在980 nm激光照射下,USD纳米颗粒立即释放NO,且NO释放量随照射时间增加。
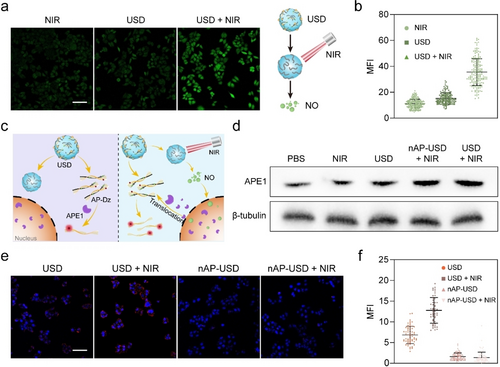
体内外实验
细胞摄取和NO生成:USD在HeLa细胞中表现出良好的DNA递送能力,并在NIR照射下显著生成NO。
基因沉默和抗肿瘤效果:USD结合NIR照射显著下调HeLa细胞中的survivin mRNA和蛋白表达水平,表现出增强的基因沉默和细胞杀伤效果。
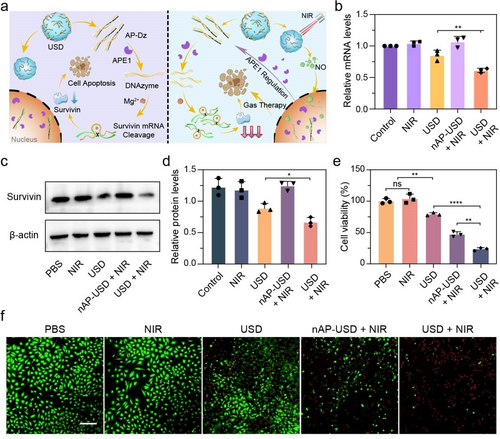
体内抗肿瘤效果:在HeLa肿瘤小鼠模型中,USD结合NIR照射显著抑制肿瘤生长,表现出优异的抗肿瘤效果和生物安全性。
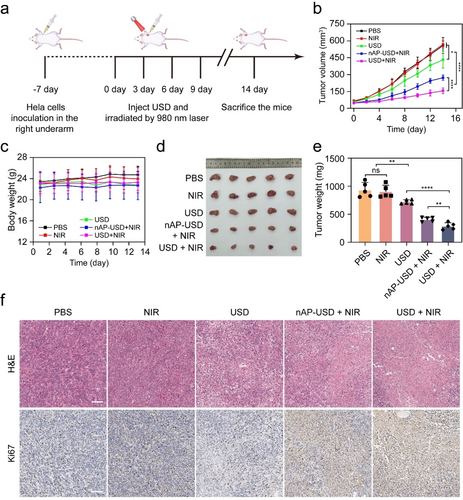
这项研究展示了NIR光触发的级联纳米系统在时空控制基因沉默和气体协同癌症治疗中的巨大潜力,为未来的癌症治疗提供了新的思路和方法。详细信息可以在这里找到。
参考文献
Cheng, Y.; Feng, Y.; Zhao, J.; Li, L.; Dong, H. Near‐Infrared Light‐Triggered Cascade Nanosystems for Spatiotemporally Controlled Gene‐Silencing and Gas Synergistic Cancer Therapy. Angew Chem Int Ed 2024, e202422375. https://doi.org/10.1002/anie.202422375.