【Angew. Chem.】📈**“16倍提升!”:揭示硫族键如何显著增强哺乳动物细胞对小分子的摄取能力**
一、研究背景与科学问题
在过去几十年里,硒(Se)和碲(Te)等硫族元素广泛应用于生物医学研究,尤其是在抗氧化、抗癌、抗病毒、神经保护等领域。尽管它们的化学活性被充分研究,但一个关键问题却被忽视:硫族元素是否能够通过非共价相互作用——即“硫族键(Chalcogen Bonding, ChB)”提高小分子在细胞中的摄取效率?
本研究由Ekta Chauhan、Dr. Debasish Giri等人团队于2025年6月发表于《Angewandte Chemie》,首次系统性地探索了硫族键在哺乳动物细胞中促进小分子摄取的可能机制及其实验验证。
二、硫族键与σ-空穴机制简介
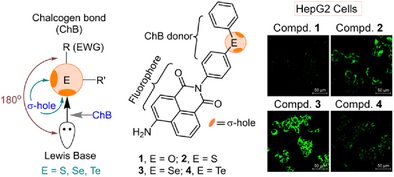
硫族键是一种由硫族原子(如S、Se、Te)通过其“σ-空穴”与路易斯碱(例如O、N、S等)形成的方向性、可调控非共价作用力。相比于卤键(Halogen bonding),硫族键可提供多向性和更强的电子接受能力。这一独特性质为其在分子识别、生物催化及药物传递等方面的应用打开新局面。
三、研究策略与分子设计
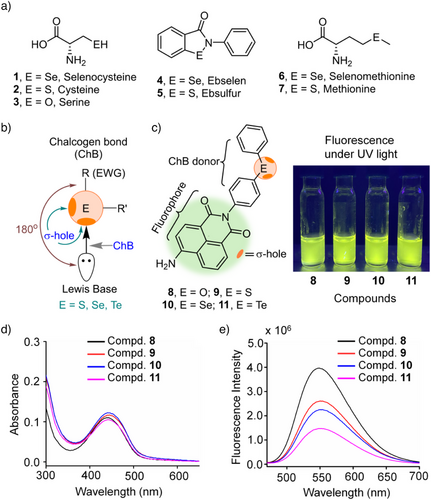
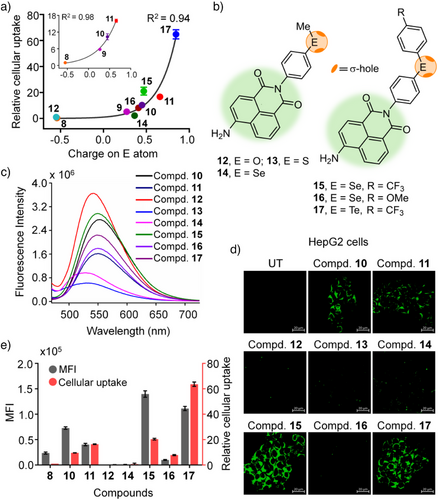
研究人员设计并合成了一系列含有不同硫族原子的荧光分子,包括氧(O)、硫(S)、硒(Se)和碲(Te)衍生物,分别命名为化合物8–11。这些化合物的核心为荧光染料萘酰亚胺(naphthalimide),侧链连接了二苯基硫族基团。
📌这些分子的优势在于:
- 发荧光可视化追踪其在细胞中的分布;
- 可控制硫族原子的种类,实现可比性;
- 可通过光谱方法测定摄取量。
此外,还设计了多个电子给体/吸电子基修饰的衍生物(如化合物12–34),以探究电子环境对σ-空穴深度及ChB作用的影响。
四、关键发现一:摄取效率与硫族原子密切相关
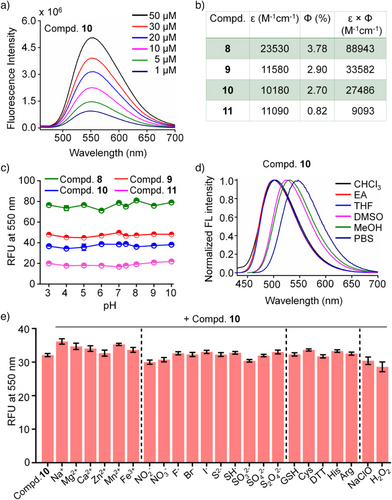
研究发现,随着原子序数从O增加至Te,分子进入细胞的能力显著增强。
- 与氧相比,碲衍生物的摄取量提升达16倍!
- 硒(Se)衍生物的摄取量约为氧的9.7倍;
- S和Se比O大幅提升细胞通透性,而不是由于疏水性变化或质子化。
这种趋势不是偶然,而是与σ-空穴的电势强度相关,原子越重、极化能力越强,σ-空穴越深,越容易与细胞膜或转运蛋白形成ChB。
五、关键发现二:电子环境可进一步调控摄取效率
在已有的基础上,研究人员通过引入不同电子性质的取代基,操控硫族原子的电荷密度。
- 引入─CF₃等吸电子基团可使σ-空穴更深,使得Te衍生物摄取量比未修饰版本再增加4倍,总提升为氧衍生物的60倍以上。
- 相反,甲基等供电子基团会削弱σ-空穴,使摄取效率下降。
这为通过分子设计优化药物传递效率提供了全新的“非共价工程”策略。
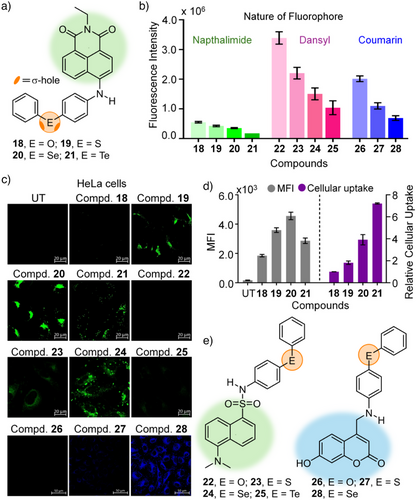
六、关键发现三:荧光染料与载体位点无直接干扰
为了排除荧光团本身对实验干扰,研究中采用了三类荧光团(naphthalimide, dansyl, coumarin)以及多种连接方式、立体构型。结果显示:
- 摄取能力主要由硫族原子决定;
- 荧光团类型或连接方式对摄取趋势无显著影响;
- 说明ChB是主导摄取效率的决定性因素。
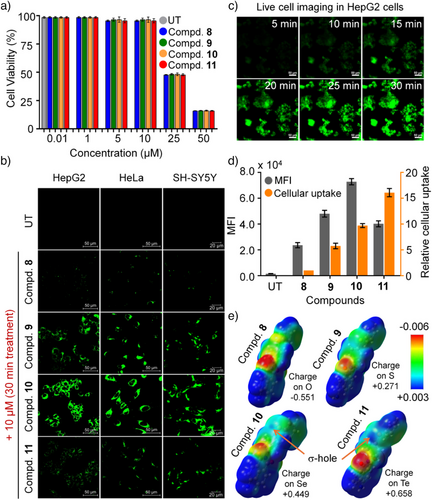
七、机制探究:通过巨胞饮作用(macropinocytosis)而非能量依赖转运
进一步的实验通过使用温度、ATP抑制剂与转运通道抑制剂,证实这些小分子:
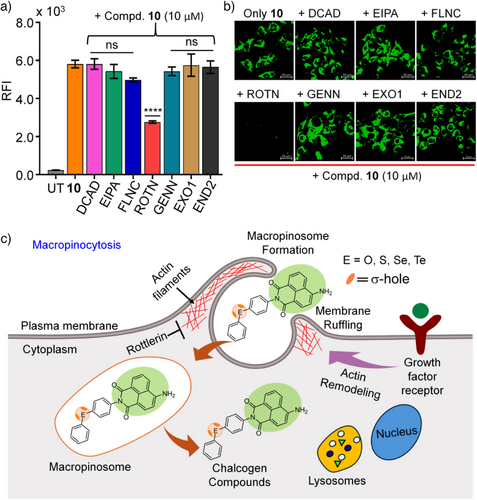
- 并非通过被动扩散进入细胞(在4°C时摄取显著减少);
- 也不依赖于传统的能量依赖内吞或载体蛋白路径;
- 可能通过巨胞饮作用或膜相互作用诱发摄取,这与ChB形成的亲和力有关。
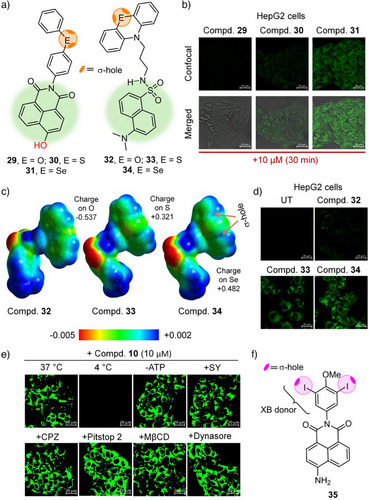
八、对比研究:Halogen Bond vs. Chalcogen Bond
研究团队还以含有两个碘原子的化合物35作为对照,其被证实可通过MCT8转运蛋白进入细胞。通过对比发现:
- 类似于卤键,ChB同样可实现转运识别机制;
- 然而ChB拥有更丰富的方向性与分子可调控性;
- 暗示未来药物可基于ChB设计更灵活高效的细胞导入路径。
九、研究意义与前景
本研究首次提出并实验验证了:可通过调节σ-空穴(即非共价键的“电子吸引区”)实现细胞摄取率的指数级提升,为:
- 药物传递系统的设计;
- 荧光探针/生物成像工具优化;
- 小分子药物口服/注射后吸收问题;
- 甚至针对性靶向传输等
提供了前所未有的新策略。
🔍结语:从σ空穴到细胞内部——开启“非共价传输工程”新纪元
这项研究以**“16倍提升”**的惊人数据及详尽的实验验证,强有力地提出:ChB不仅是分子识别、催化、固态结构的重要作用力,更是提升小分子细胞渗透性的新兴机制。下一步研究可探索其在实际药物、RNA传递、疫苗递送等领域的广泛应用。
参考文献
Chauhan, E.; Giri, D.; Govindaraj, V.; Mugesh, G. Chalcogen Bonding Boosts the Uptake of Small Molecules in Mammalian Cells. Angew Chem Int Ed 2025, e202511786. https://doi.org/10.1002/anie.202511786.