【JACS】近红外光加速生物正交药物解笼和各向异性Pd@Au等离子体纳米棒的光热消融
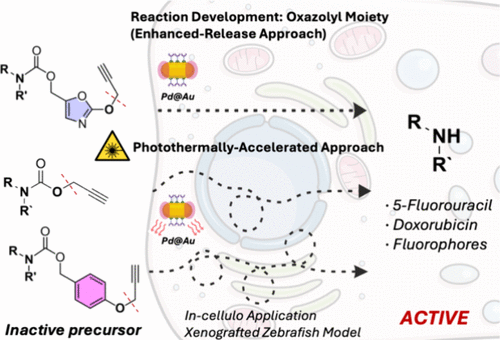
🌟 引言:为什么癌症治疗需要“动脑子”?
化疗,是与癌症长期鏖战的利器。然而传统药物“打一片”的副作用早已广为人知。如何让药物只在肿瘤“上班”,而不是“满城跑”,成为科学家孜孜以求的方向。
来自英国爱丁堡大学的一项最新研究提出了令人振奋的解决方案:在纳米尺度上植入“金属催化开关”,结合近红外激光照射,让药物在癌细胞中“就地生产”,精准释放,最大限度地减少对正常组织的伤害。
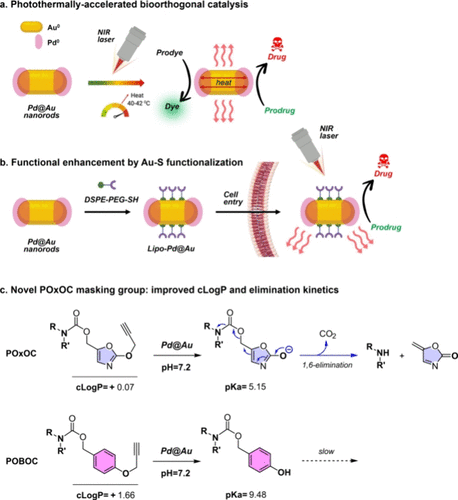
🧪 研究介绍:金+钯=聪明的纳米棒
研究团队设计出一种由金(Au)和钯(Pd)组成的纳米棒结构(Pd@Au nanorods)。它不仅能在近红外光(NIR)下产生热效应,还能充当催化剂,触发药物的“解锁释放”。
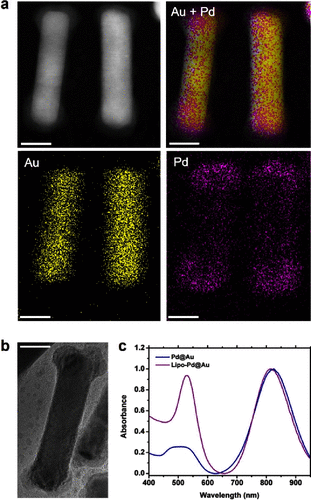
为了让这些金属纳米棒更稳定、更“耐人群”,科学家们为它们包上了一层“PEG脂质保护层”,防止其在血液中被蛋白质迅速“识破”并清除。这一改良版被命名为**“lipo-Pd@Au”**。
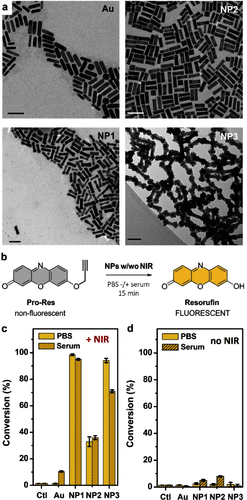
🔍 主要发现:三箭齐发,智斗肿瘤
1. 精准催化,药物原地激活
利用一种名为POxOC的新型掩蔽基团(masking group),研究人员将药物前体(prodrug)“锁住”,只有在Pd催化下才能解锁。而这个解锁过程只在NIR光照射区域发生——哪怕只照个30秒。
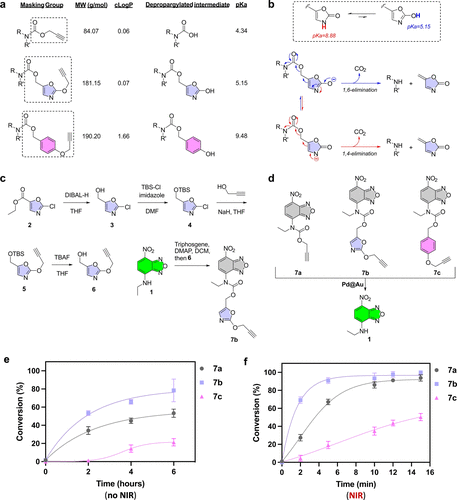
2. 热疗加持,双重攻击癌细胞
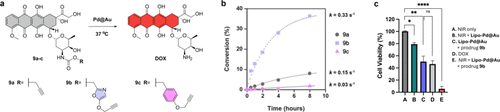
在催化释放药物的同时,纳米棒吸收激光还会“发烧”。这种光热效应进一步杀伤癌细胞,提升治疗效果。
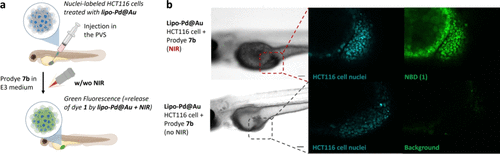
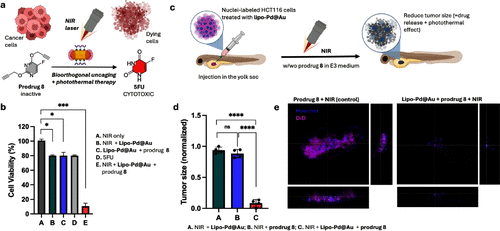
3. 实战上阵,鱼体试验大放异彩
研究团队在斑马鱼肿瘤模型中进行了测试,结果显示,经激光照射后,癌细胞区域出现明显的绿色荧光,说明药物成功在体内被激活。而肿瘤体积也显著缩小。
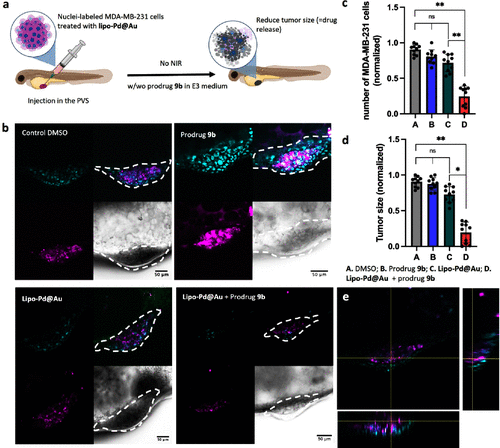
🌍 研究意义:真正的“只在肿瘤区开火”
相比传统化疗,这项技术实现了:
- 空间控制:药物只在激光区域释放,保护健康组织;
- 时间控制:激光一开,药物激活;激光一关,药效终止;
- 多效合一:集成靶向、催化和热疗于一体。
这意味着,未来我们有望将肿瘤治疗“调成精细模式”,而非“满屏幕轰炸”。
🔮 未来展望:从实验室走向临床,还有多远?
尽管目前的成果仍处于动物实验阶段,但该项技术展示了光控化疗领域的巨大潜力。接下来,研究人员将探索更具临床前景的药物分子、生物降解材料及人类细胞模型验证,迈向更安全、个性化的癌症治疗方案。
📌 关键词:纳米材料、生物正交催化、近红外光、精准治疗、斑马鱼模型
参考文献
Ortega-Liebana, M. C.; Travnickova, J.; Adam, C.; González-Calderón, D.; Lorente-Macías, Á.; Lochenie, C.; Arenal, R.; Patton, E. E.; Unciti-Broceta, A. Near-Infrared Light-Accelerated Bioorthogonal Drug Uncaging and Photothermal Ablation by Anisotropic Pd@Au Plasmonic Nanorods. J. Am. Chem. Soc. 2025, jacs.5c07261. https://doi.org/10.1021/jacs.5c07261.