【JACS】30倍增强荧光信号,650纳米发射波长——双三氟甲基罗丹明染料开启活细胞成像新时代
一、研究背景与意义
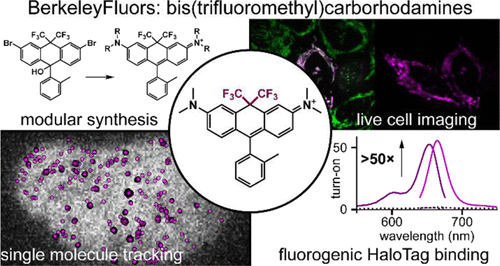
荧光染料是现代生物成像领域不可或缺的工具,尤其在活细胞成像、单分子追踪和功能成像等方面扮演关键角色。传统的罗丹明类染料(如TMR)虽然具有良好的亮度和生物相容性,但其发射波长偏短,往往落在560–590纳米区间,容易受到组织自发荧光的干扰,限制了其在深层组织和高对比度成像中的应用。
因此,研究者们一直试图推动染料向**远红光或近红外区域(>650 nm)**发展,以实现更深层、无背景的高分辨率成像。
二、BF染料的分子设计与创新点
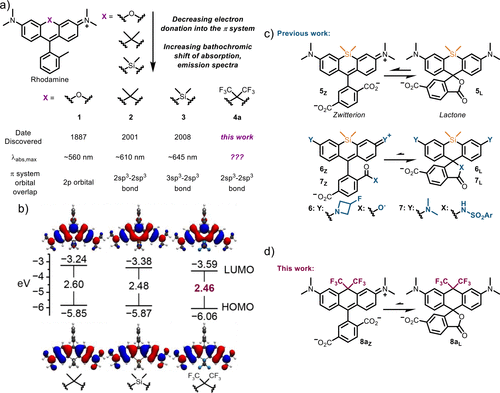
本研究提出了全新的染料设计思路——将传统羧基罗丹明(CarboRhodamine)分子结构中**10’位的双甲基(-CH₃)替换为双三氟甲基(-CF₃)**基团,从而构建出一种全新类别的染料——双三氟甲基羧基罗丹明(BF Dyes, BerkeleyFluors)。这一替换策略带来了两个显著优势:
波长大幅红移:相比传统的氧桥罗丹明染料,BF染料的激发与发射波长向红光区域推移了约90纳米,突破650纳米大关,进入远红至近红外区域。
高度荧光原位激活性(fluorogenicity):CF₃基团的强电负性使得染料更倾向于维持闭环无色状态,结合靶标后则转变为有色开放结构,荧光增强可达30倍,显著提高成像对比度。
三、计算化学验证与理论支持
研究团队运用密度泛函理论(DFT)在B3LYP/def2TZVP水平上进行了前线轨道能级计算,确认BF染料的HOMO–LUMO能隙为2.46 eV,低于CarboTMR(2.60 eV)和SiR染料(2.48 eV),为其远红特性提供了理论依据。
此外,计算结果还揭示,CF₃基团同时降低了HOMO和LUMO能级,使得染料不仅红移明显,而且闭环稳定性增强,从而提高荧光开关能力。
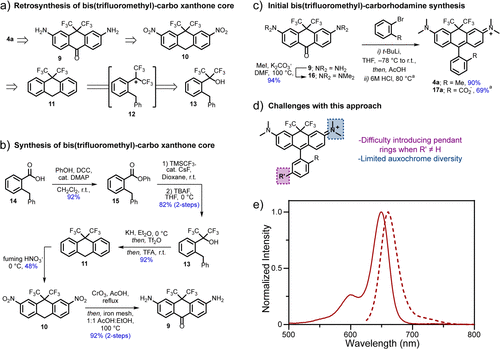
四、合成策略与结构多样化
作者开发了两条合成路线。初始路线以多步反应合成中心骨架,通过导向硝化、还原与亲核加成等步骤,最终构建出BF核心结构,并实现多种辅助基团(auxochrome)的接入,获得一系列衍生物。 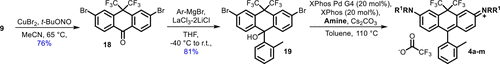
然而,为提高反应普适性与官能团兼容性,作者还开发出一条后期功能化策略:通过Sandmeyer反应将芳胺转化为溴代物,再结合Grignard加成与Buchwald-Hartwig偶联,灵活导入十余种不同氮取代基,包括:
- 四甲基、四乙基
- 碳环与氟代氮杂环(如azetidine、morpholine)
- 含硫杂环(如thiomorpholine)
- 不对称胺(如苯胺、氟乙胺)
这一策略使得BF染料的激发/发射波长可在592–661纳米之间灵活调控。
五、光物理性能与生物相容性测试
BF染料的量子产率(Φ)和摩尔消光系数(ε)均表现优异。例如,四甲基衍生物在水溶液中的Φ为33%,ε超过140,000 M⁻¹cm⁻¹,光稳定性也优于传统SiR染料。
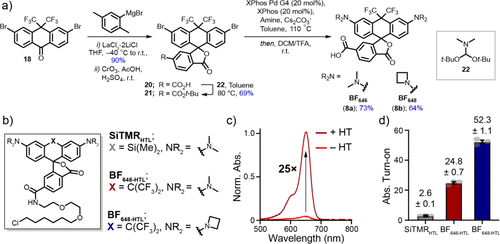
更重要的是,BF染料展示出极低的背景信号,在未结合靶标时几乎无荧光,一旦与HaloTag蛋白结合则激发出高达50倍的荧光增强,远超市售SiR标记物(一般为2–7倍)。
此外,作者进一步将BF染料成功应用于细胞器靶向成像与膜电位检测,验证其适用于无清洗成像(no-wash imaging)、光控荧光标记(chemigenetic labeling)以及单分子追踪(Single-Molecule Tracking)等高端技术。
六、活细胞成像与单分子应用拓展
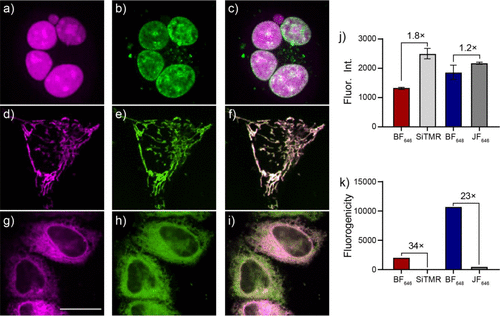
使用BF染料标记HaloTag融合蛋白,研究团队在HEK293T与U2OS细胞中实现了不同细胞器(核、线粒体、内质网)的精准靶向成像。染料展示出优异的膜通透性、生物稳定性和光稳定性。
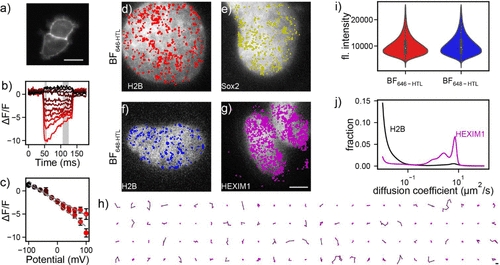
在单分子追踪实验中,BF染料成功标记了核内蛋白(如H2B、Sox2、HEXIM1),实现高分辨率的空间轨迹绘制,为探索转录因子动力学、RNA结合机制提供了强有力工具。
七、结论与展望
本研究所开发的BF染料填补了传统罗丹明染料在远红光区域缺乏高性能染料的空白,其独特的结构设计实现了**“红移波长+高荧光增强”**的协同进化。从分子设计、光物理参数到生物成像应用,BF染料系统展现出强大的功能拓展性与实践潜力。
未来,这一策略还可拓展至纳米探针设计、光遗传操控、超分辨成像等前沿技术领域,或许将在光学生物学与精密医学中掀起新一轮革命。
参考文献
Gerstner, N. C.; McCann, J. T.; Martin, J. G.; Henn, K. M.; Riske, K.; Anantakrishnan, S.; Graham, T. G. W.; Darzacq, X.; Miller, E. W. Bis(Trifluoromethyl)Carborhodamines: Highly Fluorogenic, Far-Red to Near-Infrared Dyes for Live Cell Fluorescence Microscopy, Activity-Based Sensing, and Single-Molecule Microscopy. J. Am. Chem. Soc. 2025, 147 (25), 21950–21960. https://doi.org/10.1021/jacs.5c05473.