【Adv. Mater.】“99倍荧光增强 + 9倍转换效率提升!PiPET驱动的生物正交剪切反应精准点燃肿瘤光动力疗法”
一、研究背景与瓶颈突破:生物正交反应 x 光控治疗的新纪元
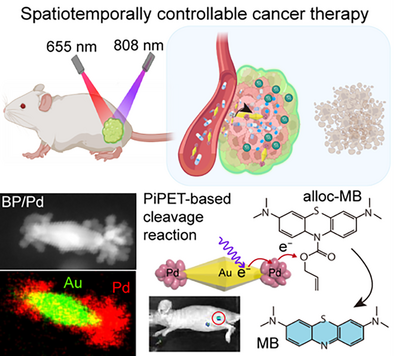
在癌症治疗的战场上,光动力疗法(Photodynamic Therapy, PDT)凭借其非侵入性、高选择性与光控时空激活能力,逐渐成为精准医疗的新宠。其原理是通过光敏剂(Photosensitizer, PS)在特定波长光照下产生活性氧(ROS),实现对癌细胞的局部杀伤。
然而,临床应用仍面临两大难题:
- 1. 光敏剂如亚甲蓝(MB)在体内迅速被还原为无活性的Leuko-MB,疗效显著下降;
- 2. 光敏剂非特异性分布及缺乏空间激活机制,易对正常组织造成损伤。
为解决这些问题,本研究提出一种革命性策略,将等离激元激发的电子转移(PiPET)机制与生物正交反应结合,成功构建了一个具备光响应、高催化活性、时空可控的纳米系统。
二、设计亮点:Au纳米双锥 + Pd点状负载的复合催化平台
核心构建为**Pd颗粒点状修饰的金纳米双锥(BP/Pd)**结构,其特点如下:
- Au纳米双锥(BP)结构尖锐,具强LSPR响应能力,在808 nm波长激发下产生局部高热与高能热载流子;
- Pd纳米颗粒选择性地锚定于BP两端(每端5 nm左右),具备优异的C–O键断裂催化活性;
- 利用Pd对烯丙基碳酸酯保护基的高效切断能力,在BP光激增强下大幅提升生物正交解笼反应效率。
该组合构建出一个无需外部酶、无毒、反应条件温和、且在肿瘤组织内可精准激活的催化平台。
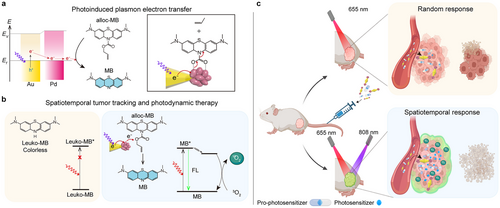
三、化学机制:烯丙基解笼 + 热电子转移增强断键效率
研究中设计了一种特殊的前体光敏剂——Alloc-MB(烯丙基碳酸酯保护的亚甲蓝):
- 常态下为无色、无荧光结构,具良好稳定性;
- 经Pd催化 + 光热触发下移除保护基,恢复为荧光MB。
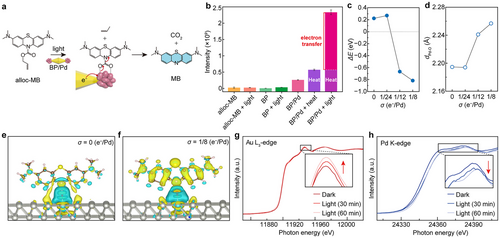
🧪光照+BP/Pd处理后:
- Alloc-MB被快速解笼,荧光信号放大达99倍;
- 相较黑暗条件提升9倍,相较热处理提升5倍;
- 证明PiPET带来的热电子注入与局部加热共同驱动反应进行。
⚡密度泛函理论(DFT)支持:
- Pd表面附加电子数增加,反应脱附能(ΔE)显著下降,由正变负;
- Pd–O键长从2.19 Å变长至2.26 Å,反应物更易解吸;
- 活化能从0.64 eV降至0.15 eV,反应速率大幅提升。
四、材料性能验证:精准成像 + 组织特异性蓄积
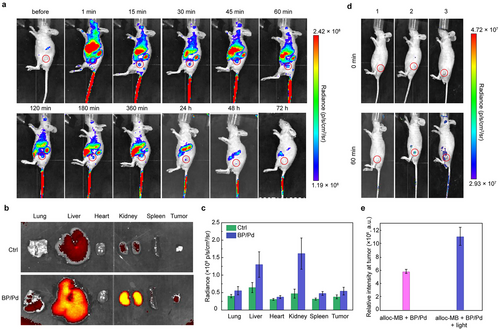
💡1. 生物分布验证
- BP/Pd通过Cy5荧光标记,静脉注射小鼠后60 min于肿瘤部位富集;
- 3天内被完全清除,无器官蓄积风险;
- 肝脏和肾脏初期清除为主,符合肝肾代谢规律。
💡2. In Vivo光控激活成像
- 背部肿瘤小鼠注射BP/Pd与Alloc-MB后,用808 nm激光照射;
- 激发808 + 655 nm双光后,肿瘤部位荧光显著增强(2倍对比未光照组);
- 避免系统性激活,实现了真正的“只在肿瘤激活”的时空控制策略。
五、体内光热协同反应:热–光协同驱动疗效叠加
- 激光照射BP/Pd纳米体系,10分钟内局部温度升至40°C;
- 控组DI水仅升温至30°C,排除非特异升温干扰;
- 光热升温不仅降低催化活化能,还增强局部肿瘤杀伤能力;
- 配合生物正交反应与后续ROS生成,形成“光控解笼 + 热效杀伤”的双模治疗模式。
六、体外机制验证:ROS提升 + 细胞杀伤显著增强
🚨1. 单态氧检测(ABDA探针):
- Alloc-MB + BP/Pd + 光照(655+808 nm)组在2 min内使ABDA降解达70%;
- 控制组几乎无反应,验证ROS产出依赖于光激与纳米催化协同。
🧫2. 细胞毒性评估:
| 处理条件 | 细胞死亡率 |
|---|---|
| Alloc-MB + BP/Pd + 808+655 光照 | >80% |
| Alloc-MB + 光照 | ~20% |
| BP/Pd + Alloc-MB(无光) | <5% |
| 光照(无药) | ❤️% |
- 明显反应特异性强,且治疗组相比空白组死亡率提升超4倍;
- 细胞存活显著依赖于生物正交剪切效率与光照协同。
七、体内治疗验证:肿瘤体积抑制 + 生存率提升
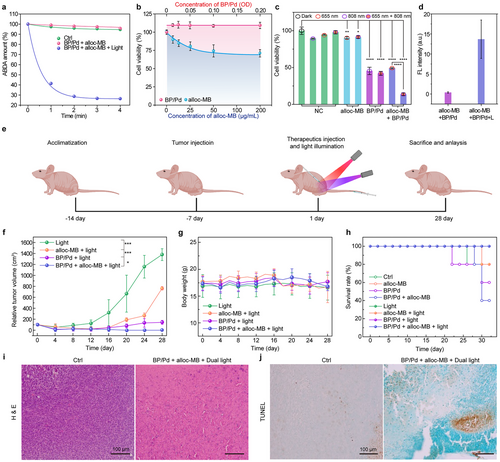
🐁BALB/c小鼠实体瘤模型:
- 分组包括PBS、Alloc-MB、BP/Pd、组合+光照等共8组;
- 监测21天肿瘤增长与生存率:
| 处理组 | 肿瘤体积增长 | 生存率(30天) |
|---|---|---|
| Alloc-MB + BP/Pd + 光照 | 显著抑制增长 | 100% |
| Alloc-MB + 光照 | 中度抑制 | 50% |
| BP/Pd + 光照 | 微弱抑制 | 60% |
| 对照组 | 快速增长 | <30% |
🧠 组织病理学验证:
- H&E染色显示治疗组肿瘤区域出现大量坏死与核碎裂;
- TUNEL染色证实细胞凋亡程度显著高于对照。
八、总结:PiPET+生物正交策略引领未来光控药物新趋势
本研究首次将等离激元增强电子转移(PiPET)机制与生物正交反应融合,实现:
🔹 亚甲蓝激活提升99倍,转化效率增加9倍
🔹 精准肿瘤定位成像,无系统性毒性
🔹 光热 + ROS协同,显著抑瘤与提升生存率
🔹 简洁、稳定、临床潜力高的纳米催化平台
📌 未来方向:
- 拓展至其他前药/抑制剂控制释放平台;
- 多模式成像组合(MRI/PA/FL)提升诊疗一体化;
- 人源化药代动力学与临床前验证。
参考文献
Yu, S.; Jang, D.; Kang, H.; Lee, H.; Park, J.; Choi, H.; Huang, W.; Kim, M.; Chung, K.; Ahn, D. J.; Liu, R.; Bang, J.; Kim, S.; Lee, L. P.; Kim, D. H. Photoinduced Plasmon Electron Transfer‐based Bioorthogonal Cleavage Reaction for Precision Tumor Therapy. Advanced Materials 2025, 2418134. https://doi.org/10.1002/adma.202418134.