【Angew. Chem.】214倍荧光信号增强!新型EC5-H3探针实现近红外活体氧化损伤精准成像
🔬一、研究背景:为何需要超高信噪比的近红外荧光探针?
在现代生物医学研究和临床诊断中,氧化应激诱导的组织损伤是多种疾病的重要标志,包括药物性肝损伤、炎症、肿瘤形成等。因此,能实时、准确识别活体内活性氧(ROS)分布的分子探针,具有重要价值。
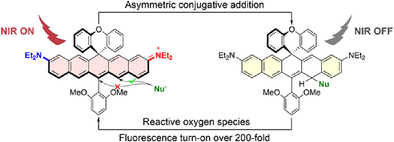
而在所有成像光谱中,**近红外区(NIR,尤其指波长大于800 nm)**具有更深的组织穿透性、更低的自发荧光干扰,理想用于活体成像。然而,目前主流的NIR荧光染料面临如下挑战:
- 光稳定性差、易氧化降解;
- 荧光开启(turn-on)倍率低,通常仅3–10倍;
- 启动反应慢,灵敏度不够;
- 无法区分组织或细胞内部氧化损伤的异质性。
本研究则突破上述瓶颈,报道了一种全新的EC5-H3探针,具有超高214倍信号增强倍率、抗破坏能力强、稳定可靠,可用于活体/组织内ROS可视化追踪,尤其在药物性肝损伤模型中表现出色。
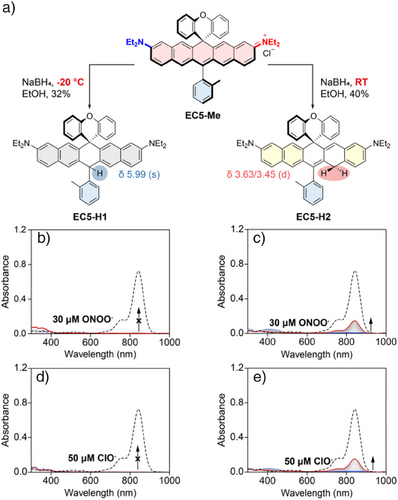
🧬二、EC5荧光母体染料的设计理念与优势
EC5为作者团队2017年开发的新型双苯并并五环结构近红外染料(bisbenzannulated xanthenoid dyes),拥有以下特性:
- 吸收/发射波长 >800 nm,适用于NIR成像;
- 高摩尔吸光系数与量子产率,荧光明亮;
- 较传统氰碱、BODIPY等染料更具光化学/化学稳定性。
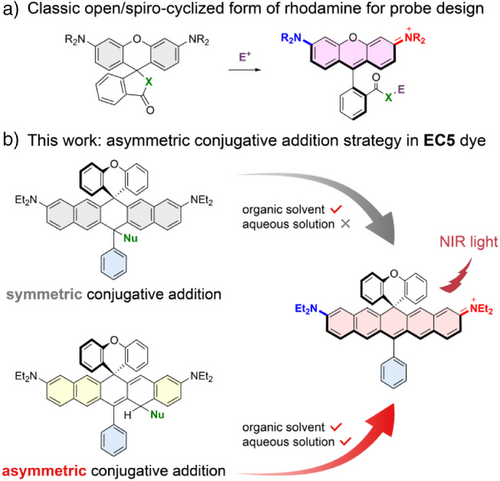
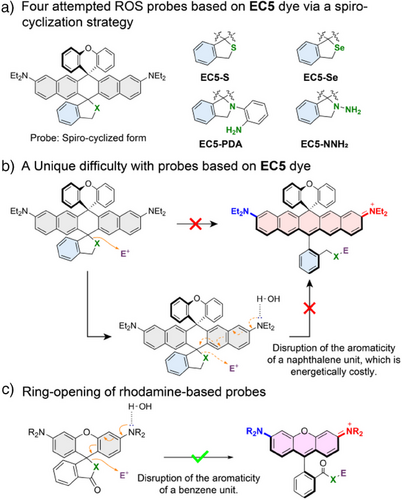
但EC5染料的特殊结构也带来新问题——其类黄烷母体上典型用于探针设计的螺环开环机制(spirocyclization)不适用。原因在于:
- 中心亚甲基(methine C)高度芳香性,开环代价大;
- 含氮供电子团在水相中形成氢键,抑制电子推动能力,影响环开;
- 常规策略(S/Se活性基团)在生理条件下无显著信号响应。
🧠三、全新探针设计策略:EC5骨架上的“非对称共轭加成”
研究者提出一种突破性机制:在EC5染料的醌甲烷位点(quinone-methide carbon)进行共轭加成还原反应,合成出“还原型EC5探针(EC5-H3)”:
- 采用NaBH₄还原优化条件,使还原选择性发生在醌甲烷位点;
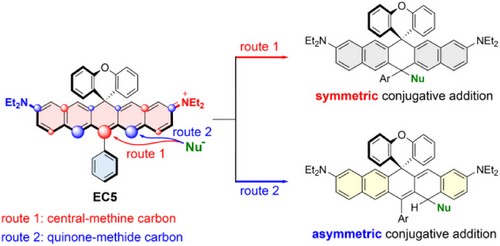
- 得到具黄色–绿色荧光特性的还原探针EC5-H3(530 nm);
- 与ROS反应后可高效氧化为原染料形式(发射峰890 nm),激发近红外荧光;
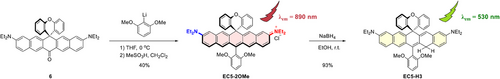
- 实现前所未有的**“零背景→强信号”式超高对比度成像(turn-on比值>200倍)**。
📈四、探针光物理性能与高信噪比验证
🔬1. 吸光与发射光谱特性
- EC5-H3无近红外吸收,发射位于530 nm;
- 经•OH或ONOO⁻氧化后,吸收峰出现在840 nm,发射峰为明亮的890 nm近红外信号;
- 开启倍率(turn-on ratio):
- 吸收:172倍;
- 发射:214倍;
- 相较主流近红外探针(通常仅5–20倍),该性能遥遥领先。
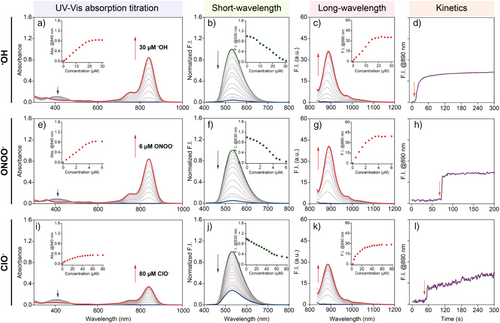
🧪2. 化学稳定性与特异性分析
- 对ONOO⁻、•OH反应迅速(秒级);
- 对ClO⁻、¹O₂反应弱;
- 无GSH、Cys、生物金属离子等干扰;
- 不受pH变化影响,适用于多种生理环境;
- 氧化产物(EC5-2OMe)具超强耐氧化与光稳定性。
🧬五、细胞水平检测ONOO⁻与肝损伤模型验证
🧫HeLa细胞实验:
- 使用SIN-1(ONOO⁻释放剂)处理HeLa细胞,EC5-H3信号大幅增强;
- 加入FeTPPS(ONOO⁻清除剂)后信号下降,验证特异性;
- 构建活性ONOO⁻升高的炎症模型(LPS+IFN-γ处理),信号增强明显;
- NAC(抗氧化剂)可显著抑制发光,说明探针反应依赖ROS上调。
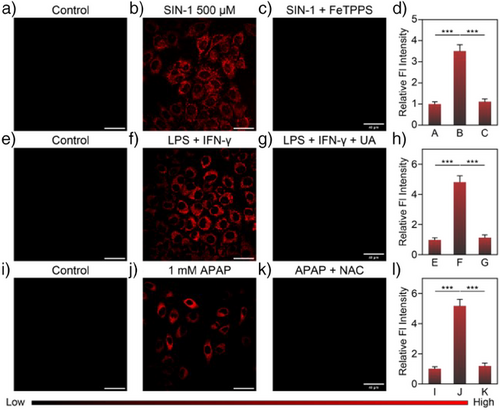
🧬APAP(对乙酰氨基酚)肝损伤模型:
- 细胞暴露于APAP(0.25–1.0 mM)后,呈现剂量依赖性荧光增强;
- NAC前处理可抑制增强,进一步验证为ROS诱导。
🐭六、活体小鼠成像:检测肝损伤的动态变化
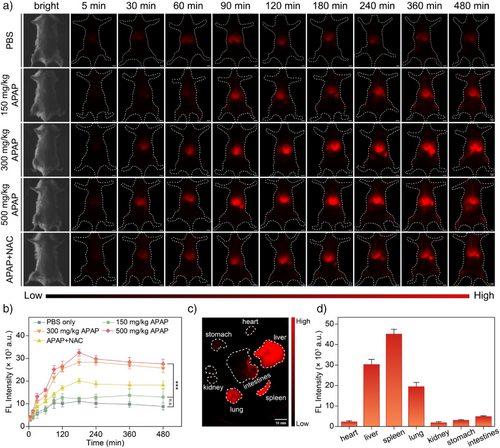
将探针应用于小鼠APAP肝损伤模型,使用NIR-II荧光成像系统(激发波长808 nm,发射>1100 nm):
| 分组 | 处理方式 | 荧光信号强度变化 |
|---|---|---|
| 对照组 | PBS | 微弱上升(基础代谢) |
| 低剂量APAP | 150 mg/kg | 无显著增强 |
| 中/高剂量APAP | 300/500 mg/kg | 明显增强,说明氧化应激显著 |
| NAC+APAP | NAC预处理后注射APAP | 信号部分恢复至低水平 |
此外:
- 肝区信号持续增强超过8小时;
- 信号主要集中在肝脏与脾脏,体现器官特异性。
🔬七、组织切片成像揭示损伤异质性与细胞特异性
将小鼠肝脏冷冻切片(OCT包埋)进行共聚焦成像:
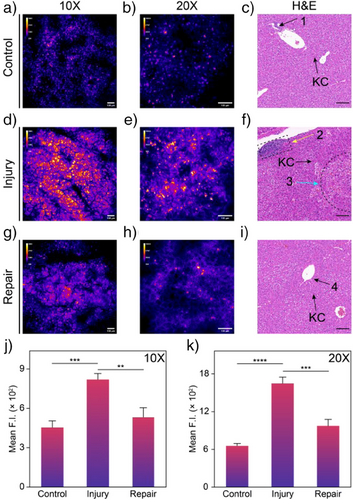
- 肝损伤组信号最强;
- 修复组次之,对照组最低;
- 局部高亮荧光斑点(非均一分布),提示肝内细胞间存在氧化水平异质性。
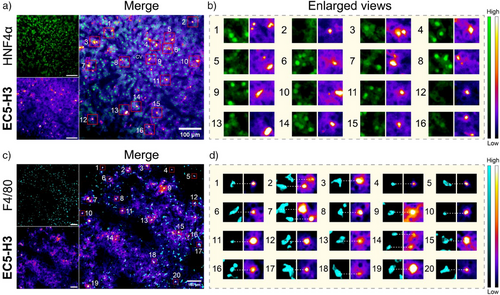
🧬细胞定位验证:
- 与HNF4α抗体(肝实质细胞)共染色:信号基本不重叠;
- 与F4/80抗体(巨噬细胞)共染色:高度重叠;
- 推断:EC5-H3主要在肝巨噬细胞中富集并被氧化→产生荧光。
🧫八、脾脏区域信号来源分析
- 发现脾脏边缘区(MZ)富集信号;
- MZ为血液滤过与巨噬细胞富集区;
- 共染结果验证F4/80⁺脾巨噬细胞中信号强烈;
- 说明EC5-H3除用于肝损伤外,也具备免疫监测潜能。
🧩九、理论计算支持机制合理性
基于DFT分析:
- EC5-H3的HOMO能级高于EC5-H1/EC5-H2,最易被氧化;
- 表明该还原位点化学设计具备结构合理性;
- 荧光信号变化的高速、低背景、高对比度来自分子轨道分布优势。
🔚十、总结与展望
本研究成功构建近红外发射波长达890 nm,激发比214倍的EC5-H3 ROS探针,并通过体外、细胞及活体等多层级系统性实验验证其优越性能,主要亮点包括:
- 🧠设计创新:跳出传统spiro-cyclization,采用共轭加成;
- 💡性能卓越:超高turn-on倍率、光稳定性
参考文献
Hu, X.; Yao, C.; Wang, B.; Zhang, Y.; Yang, J.; Dong, Y.; Li, Y.; Wang, D.; Chen, X.; Deng, Y.; Ge, G.; Zhou, B.; Luo, X.; Qian, X.; Yang, Y. Near‐Infrared Biosensing of Drug‐Induced Cell‐Heterogeneous Injuries with an Ultrahigh Turn‐On Ratio. Angew Chem Int Ed 2025, e202503579. https://doi.org/10.1002/anie.202503579.