【Biomaterials】2大核心×3大影像×4重协同!Ce6@QAS纳米泡助力黑色素瘤杀伤率80%
背景与挑战
随着黑色素瘤发病率快速上升,传统光动力(PDT)/声动力疗法(SDT)面临穿透不足、靶向性差、单一机制难以根除肿瘤等难题。如何在“看得见”与“打得准”之间实现无缝衔接,成为转化临床的关键。 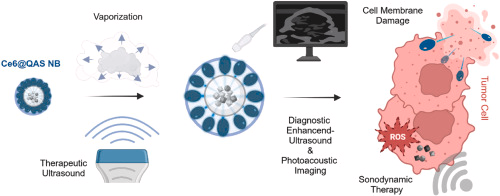
Ce6@QAS纳米泡:材料与设计
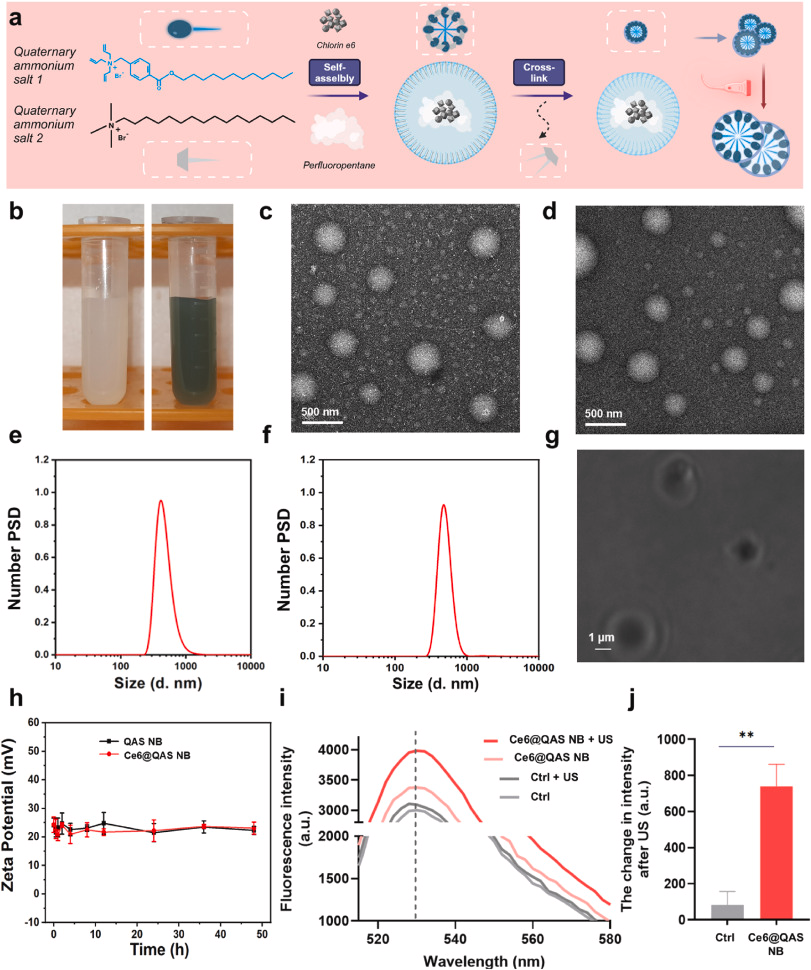
- 材料组成
- 壳层:季铵盐(QAS)壳,可在酸性肿瘤微环境中释放,精准破坏细胞膜
- 核心:过氟戊烷相变液,超声诱导下液-气转换,实现增强超声成像
- 负载:声敏剂Ce6,实现光/声双模成像与SDT
- 尺寸与表面
- 直径约400 nm,正电荷有助于肿瘤富集和细胞摄取
- 交联结构赋予纳米泡优异的血液稳定性
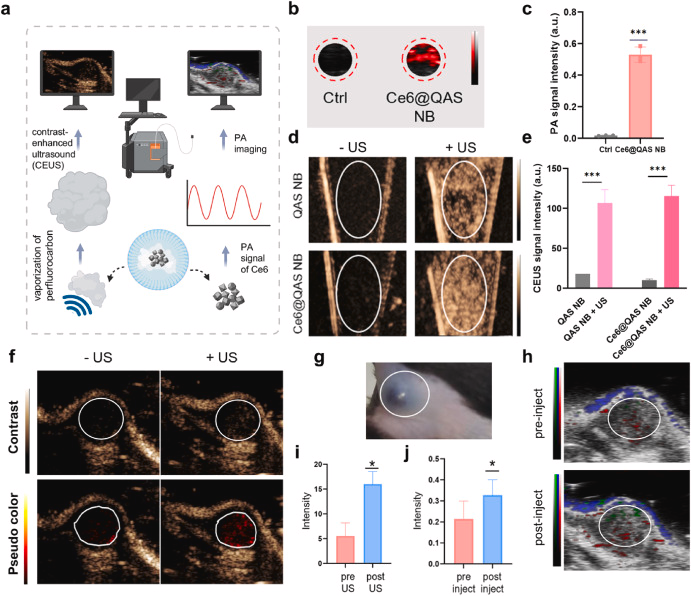
三大成像模式导航
- 超声造影(CEUS):过氟戊烷相变后的纳米气泡,提供高对比度实时成像
- 光声成像(PA):Ce6的光吸收特性,实现肿瘤定位与药物分布监测
- 荧光追踪:Ce6本身荧光可用于体外细胞摄取及分布研究
四重协同抗瘤机理
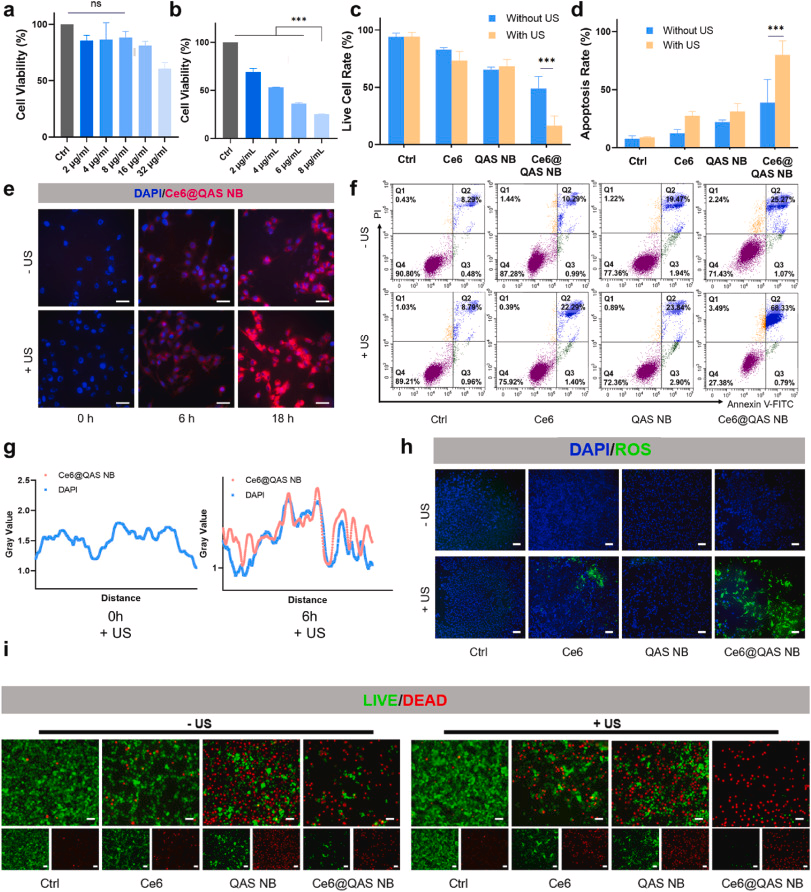
1. 精准细胞膜破坏
QAS壳在酸性环境下断裂释放,刺破肿瘤细胞膜,引发细胞内容物外溢。
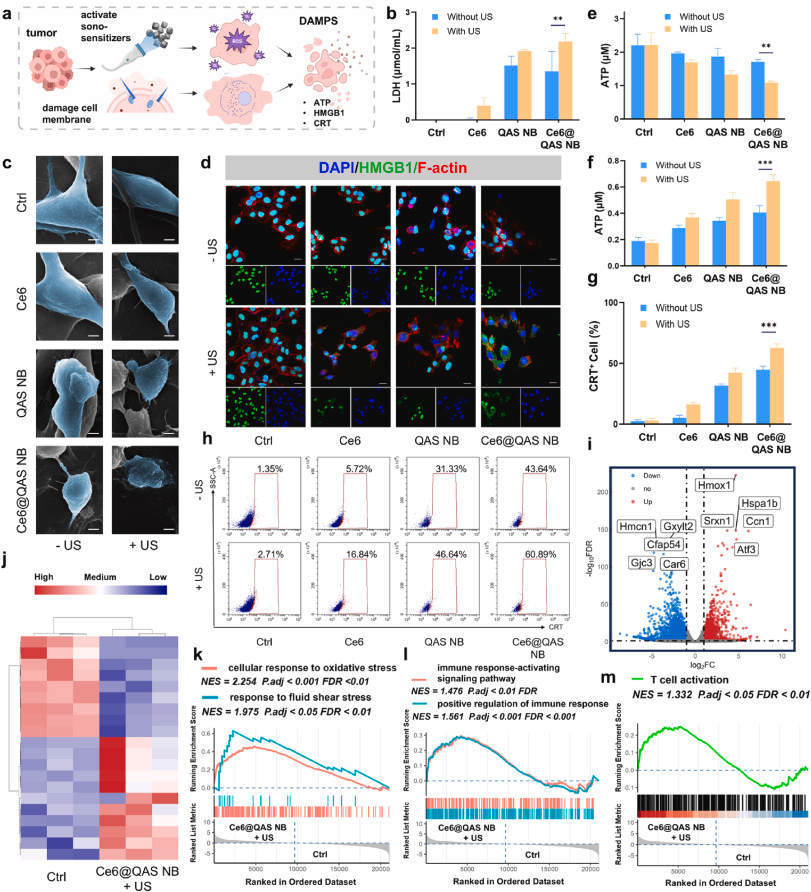
2. 增强声动力疗法
超声激活Ce6产生活性氧(ROS),协同膜破坏实现化学+物理双杀伤。
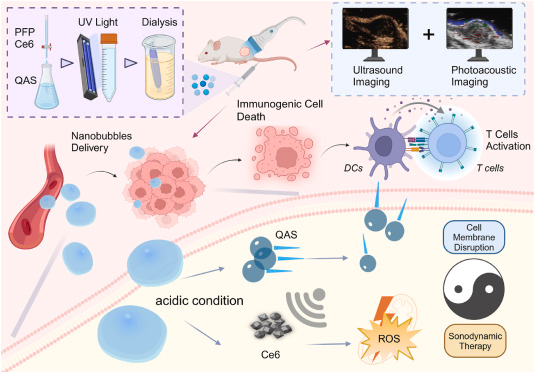
3. 诱导免疫原性死亡(ICD)
联合机制促使ATP、HMGB1释放及CRT外翻,激活树突状细胞,重塑免疫微环境。
4. 可控给药与生物安全
超声“开关”式释放,减少正常组织毒性,纳米泡血流循环境稳定,安全性高。
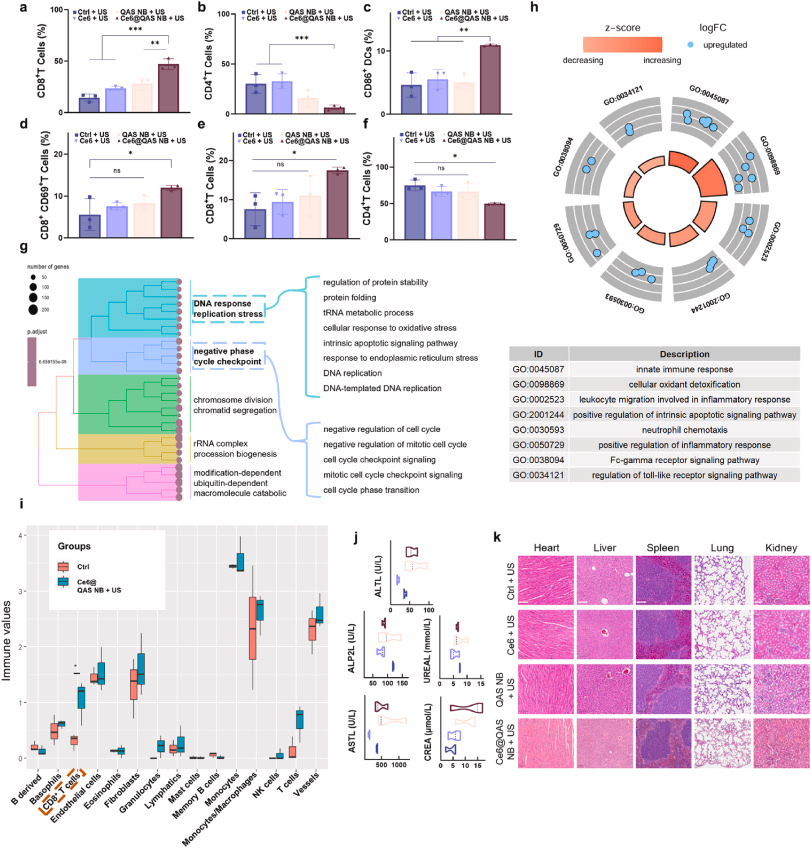
体外/体内验证
- 体外:B16-F10细胞,8 μg/mL浓度+超声,存活率降至25%,细胞膜破坏与ROS荧光强度显著上升;
- 免疫标志:外泌ATP↑、HMGB1由核向质外转移、CRT暴露>60%;
- 体内:小鼠黑色素瘤模型,CEUS/PA双模引导下,肿瘤体积显著缩小,免疫细胞浸润增强,长期无复发。
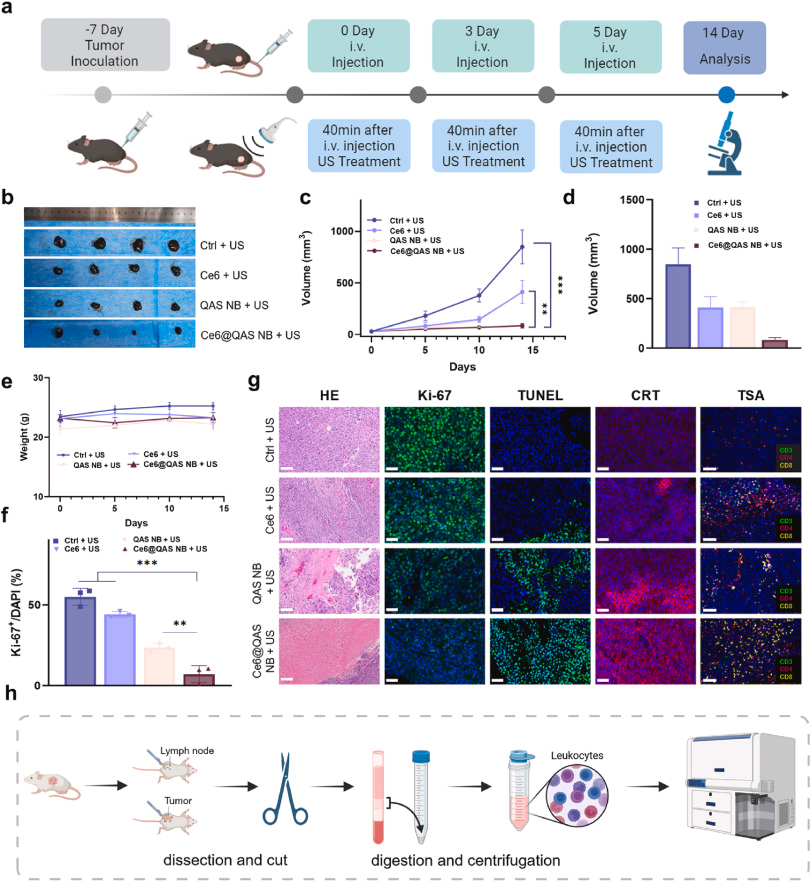
展望与思考
Ce6@QAS纳米泡以2种活性组分、3种影像手段、4重协同效应,集“看、杀、免”于一体,呈现对黑色素瘤的高效精准打击。然而,从工艺放大、长期安全评价到临床转化,仍需优化、验证与多中心合作。未来,可结合PD-1/PD-L1免疫检查点治疗,进一步提升疗效与患者预后。
参考文献
Feng, Z.; Yao, Y.; Wang, Z.; Xiang, X.; Wang, L.; Xiao, X.; Tang, Y.; Hu, W.; Qiu, L.; Qian, Z. A Multimodal Imaging Nanobubble Enhancing Sonodynamic Therapy by Cell Membrane Disruption for Effective Anti-Melanoma. Biomaterials 2026, 324, 123450. https://doi.org/10.1016/j.biomaterials.2025.123450.