【JACS】每秒旋转300万次!分子马达揭示击杀癌细胞与钙信号传导的关键机制
一、研究背景与创新意义
在传统生物医学中,化学手段通常是操控细胞行为的主要方式,例如药物治疗。然而,细胞不仅对化学刺激敏感,还能响应机械、热能及光学等多种外部信号,尤其是近年来“分子机械力”对细胞功能影响的研究逐渐成为热门课题。相较于微米级的物理刺激方式(如显微针刺激),“分子马达”(Molecular Motors,MMs)提供了一种从纳米尺度上直接作用于细胞内部的新机制。
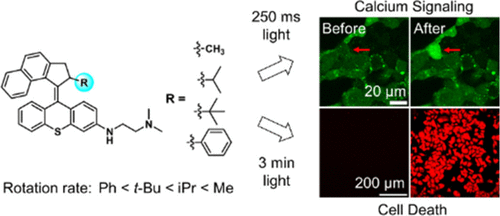
本文作者团队系统地研究了由“Feringa型过度拥挤烯烃”结构构成的合成型分子马达,并证明了其通过快速、单向的旋转动作可有效杀死癌细胞或引发细胞内钙信号。这项研究首次明确提出马达的旋转速率对生物效应的决定性影响,并非此前部分研究者提出的“光热效应”或“光动力效应”。
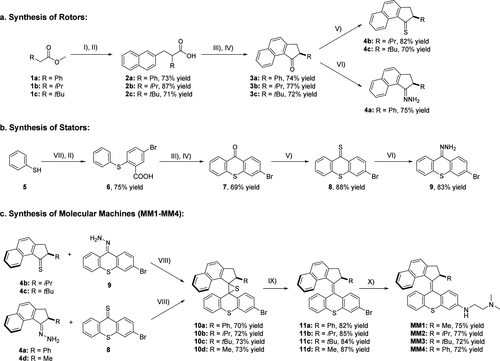
二、分子马达结构设计与旋转动力学调控
研究人员合成了四种结构高度相似但转子取代基不同的MMs(分别为甲基、异丙基、叔丁基和苯基),以系统探究“空间位阻”对马达旋转效率的影响。这四种马达在紫外线(400nm)照射下均可启动旋转,然而因为转子的大小不同,其“热螺旋反转”(THI)所需能量屏障不同,导致旋转速率亦不相同。
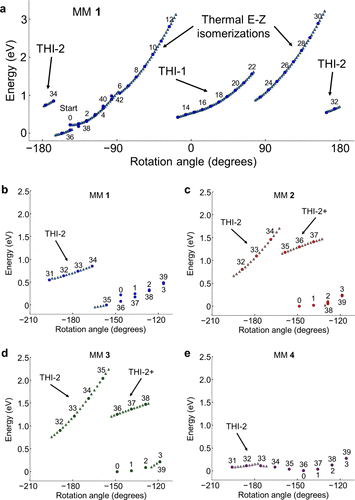
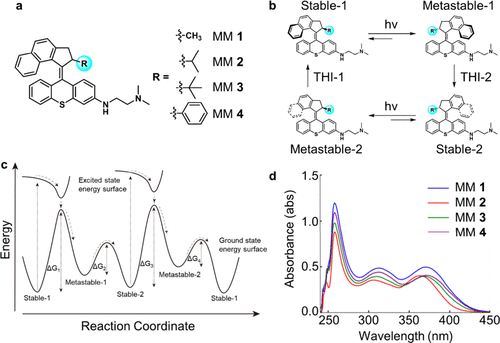 密度泛函理论(DFT)计算显示:
密度泛函理论(DFT)计算显示:
- 甲基取代的MM1旋转最快,达到约300万次/秒;
- 随着空间位阻的增加(苯基最大),旋转速率显著下降;
- MM4(苯基)几乎不具有单向旋转性,更像是分子“开关”。
这种“细微的结构调控带来的功能差异”正是分子机械化学的精髓所在。
三、旋转速率对细胞响应的直接影响
通过细胞培养实验,作者将不同MMs加入人类胚胎肾(HEK)细胞中,在短时间照射下进行以下两类观察:
细胞存活率与凋亡率检测:
- 在相同照射条件下,MM1诱导的细胞死亡率远高于其它三种;
- MM4几乎不引起细胞死亡,这验证了旋转速率与杀伤效果正相关。
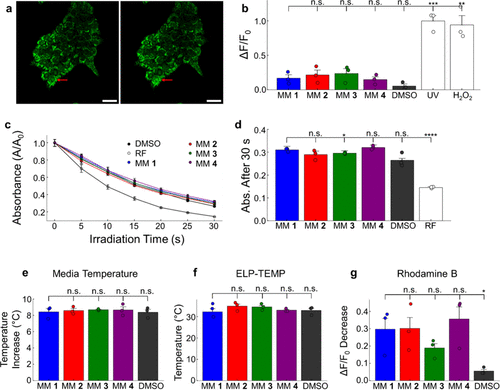
细胞内钙离子信号检测:
- 使用荧光钙离子探针监测发现,只有旋转速率较快的MM1与MM2能诱发明显的钙离子内流;
- 表明这些分子马达可快速扰动细胞膜、引发离子通道响应。
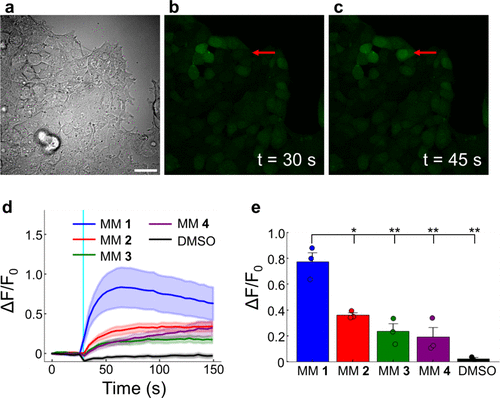
结论:马达的机械旋转而非光热或ROS机制才是其引发细胞反应的主导因素。
四、排除其他可能机制的严密实验证据
为了验证马达的效应并非来源于热或活性氧(ROS),研究者做了如下实验:
ROS检测(包括CellROX染料及DPBF法):
- 所有MM在细胞内产生ROS水平低于传统UV照射或H₂O₂处理;
- 在无细胞环境下,MM甚至表现出“清除氧自由基”的特性而非产生。
局部温升实验:
- 使用温敏荧光蛋白与罗丹明B记录,确认激光照射下局部温度仅升高2~3℃;
- 与细胞活性刺激无直接相关性。
此部分严密排除非机械性机制的实验设置,极具说服力地证实分子马达机械旋转为主要效应因子。
五、潜在的应用前景与挑战
本研究打开了“分子力学”干预细胞行为的新篇章,尤其在以下领域前景广阔:
- 精准癌症治疗:利用高速旋转马达在肿瘤细胞膜上打孔,引发快速凋亡;
- 神经科学研究:通过操纵钙信号通道调控神经元激活;
- 合成生物与仿生机械设计:设计“智能响应材料”或“微尺度纳米机器人”提供设计蓝本。
不过,仍面临一些挑战:
- 如何提高马达在生理环境中的稳定性与靶向性;
- 如何实现马达运动可视化与实时追踪;
- 如何大规模廉价合成此类复杂结构。
六、总结:速度就是力量,机械旋转的新纪元
本研究以精妙的结构设计、严格的控制实验、跨学科手段系统验证,首次揭示:“每秒旋转百万次”的分子马达,其机械旋转效应才是细胞反应的核心机制。
相比传统药物通过靶标结合进行调控,此类机械马达提供了一种全新思路——直接通过物理动作干扰细胞结构或信号机制。这是从“化学-生物干预”到“机械-分子操作”的跃迁。
参考文献
Arnold, D.; Li, B.; Beckham, J. L.; Lopez-Jaime, K.; Ayala-Orozco, C.; Rui, Y.; Chaudhry, G.; Seminario, J. M.; Tour, J. M. Rotation Kinetics of Molecular Motors Influence Their Ability to Kill Cancer Cells and Induce Cellular Calcium Signaling. J. Am. Chem. Soc. 2025, jacs.4c17732. https://doi.org/10.1021/jacs.4c17732.