【JACS】2层包裹+1步触发:口服益生菌–药物偶联物精准治愈溃疡性结肠炎
研究背景
溃疡性结肠炎(UC)是一种慢性肠道炎症性疾病,因传统疗法多依赖单一机制、药物无序释放及非靶向分布,常导致疗效不佳和显著副作用。长期未获控制的炎症还会增加结肠癌风险。
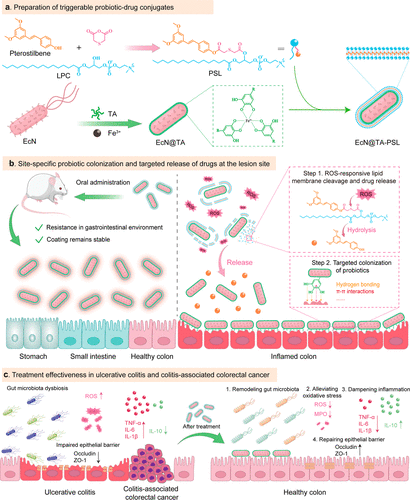
技术创新
内层包裹
以单宁酸(TA)和铁离子(Fe³⁺)现场配位,构建金属多酚网络(MPN)内层,包裹益生菌Escherichia coli Nissle 1917(EcN),显著提升菌体在胃酸、胆盐等恶劣环境下的存活率并增强黏附性。外层响应
合成含硫醚键的白藜芦醇-脂质(PSL)外层,在高水平活性氧(ROS)条件下可触发硫醚键断裂,实现白藜芦醇的按需释放,同时脱覆的TA层益生菌同步释放至病灶。
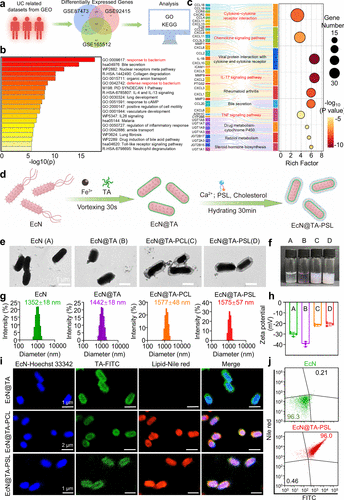
制备与表征
- 先将EcN与FeCl₃、TA混合,30秒振荡形成EcN@TA内层。
- 随后在含Ca²⁺的PBS中与PSL及胆固醇孵育,得到EcN@TA-PSL双层偶联物。
- TEM、DLS和ζ电位测试显示:
- 粒径从原EcN的1352 nm增至EcN@TA-PSL的1575 nm;
- ζ电位由–30 mV提升至约–21 mV;
- 荧光标记及流式细胞验证了双层均匀包覆。
同步靶向释放机制
口服给药后,偶联物可耐胃肠道环境,当到达炎症病灶,高水平ROS触发PSL外层降解,迅速释放白藜芦醇与TA黏附益生菌:
- 白藜芦醇具抗炎和ROS清除活性,修复局部微环境;
- 黏附性益生菌定植病灶,持续调控肠道菌群平衡。
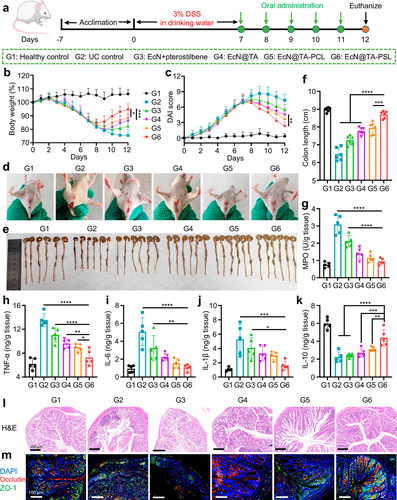
疗效验证
在UC小鼠模型中,EcN@TA-PSL处理组表现出显著的炎症抑制和黏膜修复;在结肠炎相关癌(CAC)模型中,还展现出预防肿瘤发生的潜力,凸显其治疗和预防双重作用。
临床前景
- 口服给药简便,无需侵入性操作。
- 联合益生菌和小分子药物,可兼顾短期抗炎与长期菌群调控。
- 有望拓展至克罗恩病、化疗引发的肠损伤等其它胃肠道疾病。