【JACS】5.8 GM突破!BODIPY光笼实现近红外双光子激活新里程碑
在《美国化学会志》最新发表的一项研究中,科学家们成功开发出一类可在900–1500 nm近红外窗口内激活的BODIPY光笼分子,为深层组织光控释放技术带来突破性进展。
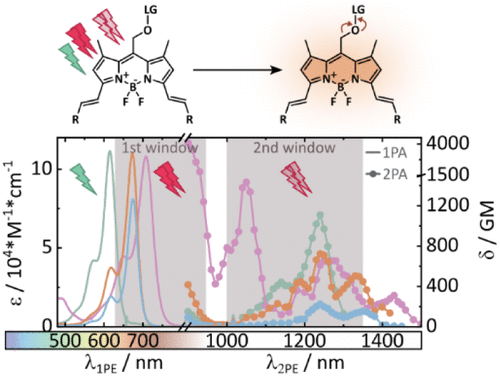
📌研究背景:光控释放的挑战与机遇
光笼分子是一类可通过光照释放功能基团的化合物,广泛应用于药物释放、生物成像和光动力治疗等领域。然而,传统光笼多依赖紫外或可见光激发,穿透组织能力有限,限制了其在体内应用。
为解决这一问题,研究者转向近红外(NIR)和短波红外(SWIR)波段,尤其是第二生物窗口(1000–1350 nm),该波段具有更佳的组织穿透性和更低的光毒性。
🔬研究亮点:11种BODIPY衍生物的系统筛选
本研究系统分析了11种在3位和5位进行结构修饰的BODIPY衍生物,探索其双光子吸收(2PA)性能。主要发现包括:
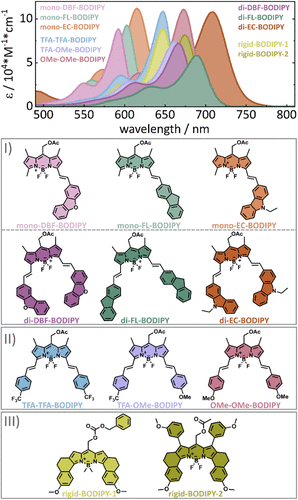
- 最高2PA截面达4000 GM:双苯乙烯-卡唑修饰的BODIPY在900 nm处表现出极高的双光子吸收能力。
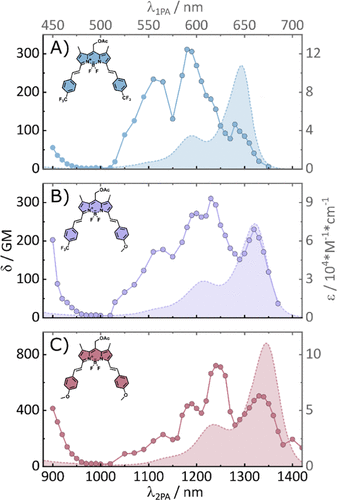
- 在1240 nm仍保持1110 GM:其单苯乙烯类似物在更长波长下仍具显著吸收。
- 光释放效率显著提升:两种B位甲基化分子在900 nm处的光释放截面(δΦu)达5.8 GM,在1300–1400 nm处也保持约1 GM。
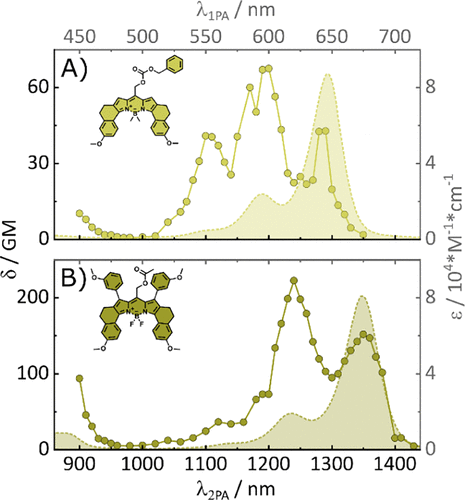
⚙️机制解析:结构调控如何提升性能
研究发现,增强分子内电荷转移特性和振动自由度,有助于打破对称性选择规则,从而提升2PA效率。此外,修饰并未破坏BODIPY核心的光物理性质,保留了其良好的分子工程潜力。
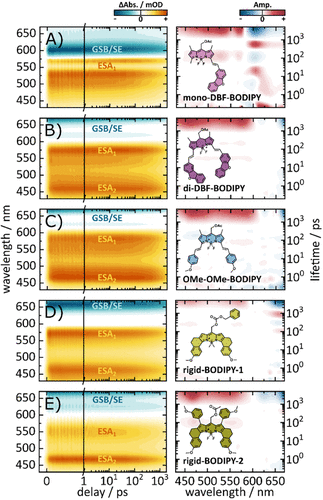
通过量子化学计算和瞬态吸收实验,研究者进一步揭示了不同取代基对激发态动力学和荧光寿命的影响,为未来设计高效光控分子提供了理论依据。
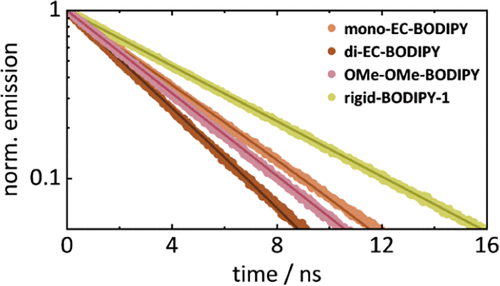
🚀应用前景:迈向深层组织光控释放
本研究首次在第二生物窗口实现高效双光子激活的BODIPY光笼,表明即使每个SWIR光子仅携带约20 kcal/mol能量,也足以引发C–O键断裂。这一发现为开发可在深层组织中精准控制的光敏分子奠定了基础。