【Angew. Chem.】碳掺杂铜氮化物纳米酶乳酸氧化酶 (LOX) 活性,下调肿瘤细胞中的乳酸水平,重新编程乳酸稳态
简介
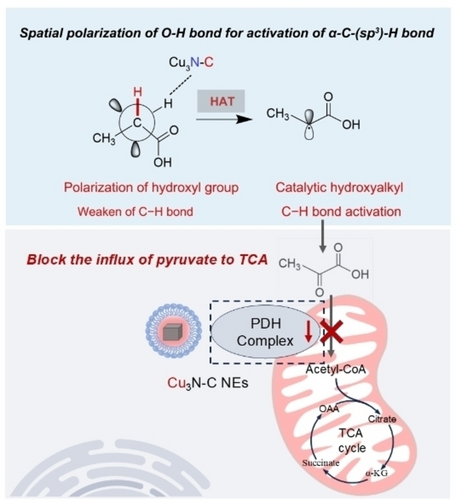
本文研究了一种基于碳掺杂铜氮化物纳米酶 (Cu3N−C NE) 的纳米催化药物,旨在通过增强乳酸氧化酶 (LOX) 活性,降低肿瘤细胞乳酸水平,并阻断线粒体呼吸,以实现肿瘤免疫抑制的重塑。
摘要
异常的乳酸代谢导致肿瘤微环境中的免疫逃逸。本研究设计了一种基于碳掺杂铜氮化物纳米酶 (Cu3N−C NE) 的纳米催化药物,增强了乳酸氧化酶 (LOX) 活性。计算结果表明,碳的引入有利于通过氢原子转移过程活化乳酸中的羟基烷基 C-H 键。Cu3N−C NE 能够下调肿瘤细胞中的乳酸水平,并阻止生成的丙酮酸进入线粒体呼吸,重新编程乳酸稳态。研究为下一代乳酸调节纳米医学的设计提供了概念验证。
研究结果与讨论
材料的制备与结构表征
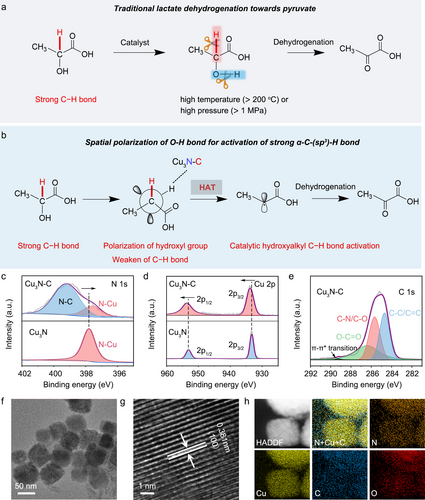
研究首先制备了碳掺杂铜氮化物酶 (Cu3N−C NE) 和未掺杂的 Cu3N,并通过 X 射线粉末衍射 (XRD) 和 X 射线光电子能谱 (XPS) 进行了表征。TEM 图像显示,Cu3N−C 具有约 50 纳米的立方结构。
乳酸的催化氧化效应
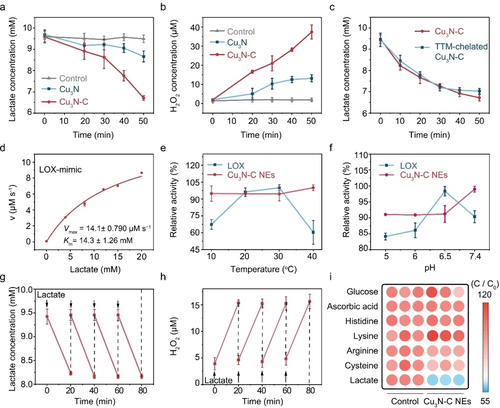
通过与 Cu3N−C 和 Cu3N 反应,观察到了乳酸的显著消耗,证明了掺杂异质原子对其催化氧化性能的促进作用。进一步研究表明,Cu3N−C 的 N 原子在乳酸催化氧化中起关键作用。
密度泛函理论 (DFT) 计算
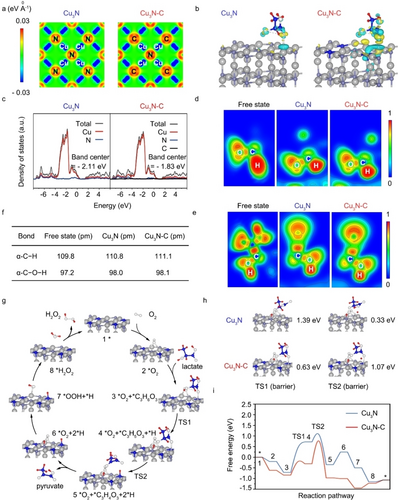
DFT 计算揭示了 Cu3N−C 在模仿天然 LOX 方面的活性增强机制,包括电子密度分布、电子转移和吸附能的变化。
乳酸引发的免疫抑制重塑
实验表明,Cu3N−C NE 可以通过降低乳酸水平和提高 pH 值逆转肿瘤微环境的酸化,并成功重塑免疫抑制。
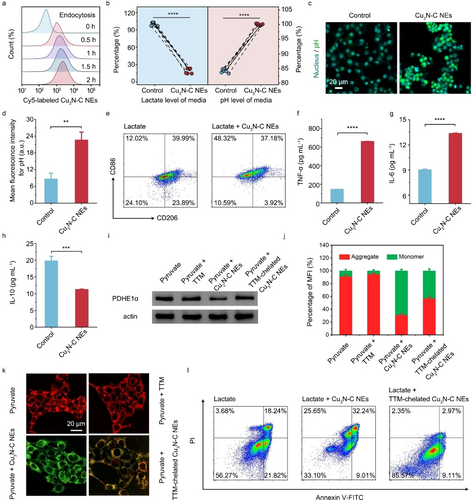
丙酮酸诱导的线粒体呼吸阻断
研究表明,Cu3N−C NE 不仅能消耗乳酸,还能阻断生成的丙酮酸进入线粒体呼吸,从而抑制肿瘤细胞存活。
Cu3N−C NE 的抗肿瘤性能
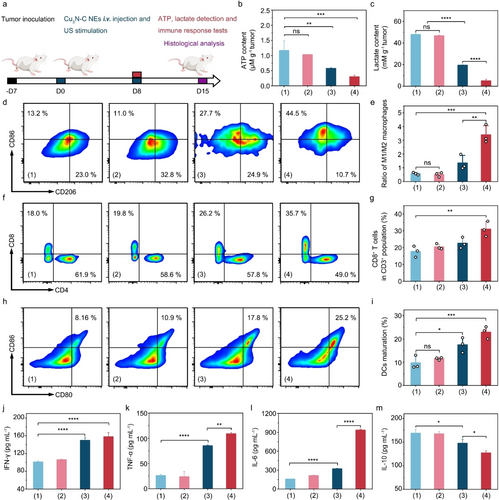
在体内实验中,Cu3N−C NE 表现出显著的抗肿瘤效果,特别是在结合超声波刺激时,效果更为明显。同时,安全性实验显示 Cu3N−C NE 对非癌细胞的毒性较低。
结论
本文研究证实,碳掺杂铜氮化物纳米酶 (Cu3N−C NE) 通过增强乳酸氧化活性和阻断线粒体呼吸,实现了乳酸稳态重编程和肿瘤免疫抑制的重塑。这一新型纳米催化药物为乳酸调节疗法提供了新的思路,并展示了其在抗肿瘤治疗中的潜力。
参考文献
Zhao, S. et al. Lactate‐Modulating Nanozyme‐Mediated Mitochondrial Respiration Block for Tumor Immunosuppression Remodeling. Angew Chem Int Ed e202422203 (2025) doi:10.1002/anie.202422203.