【Adv. Mater.】克服放疗抗性,基于离子发生器的放疗增强策略诱导铁死亡并激活 STING 信号通路
简介
本研究提出了一种基于离子发生器的放疗增强策略,利用铁和锰离子联合诱导癌细胞铁死亡和激活 STING 信号通路,以克服放射抗性并改善肿瘤免疫微环境。
摘要
放疗依赖于 DNA 损伤引发的癌细胞死亡和随后的抗肿瘤免疫反应。然而,细胞周期异质性和免疫抑制性肿瘤微环境削弱了放疗效果。本研究在小鼠模型中展示了一种基于离子发生器的放疗增强策略,该离子发生器在肿瘤微环境中释放铁和锰离子,从而诱导铁死亡并激活 STING 信号通路,增强肿瘤免疫反应。结果表明,这种策略可显著抑制放射抗性肿瘤及其远处转移,提高放疗临床效果。
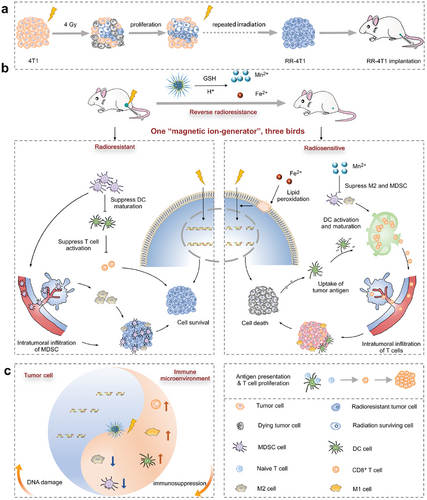
研究结果与讨论
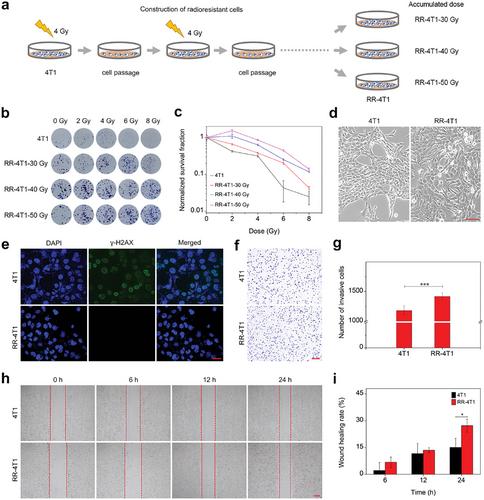
建立放射抗性细胞模型
通过 X 射线辐照建立 RR-4T1 细胞株,并验证其抗辐射特性。结果显示,RR-4T1 细胞在 50Gy 辐射剂量下存活率显著提高,侵袭和迁移能力增强,表明成功构建了放射抗性乳腺癌细胞模型。
Fe 掺杂 Mn3O4 纳米颗粒的合成与表征
利用一步热注入法合成 Fe 掺杂 Mn3O4 纳米颗粒,并通过配体交换和聚乙二醇修饰提高其生物相容性和稳定性。不同掺杂水平的纳米颗粒在肿瘤微环境中表现出显著的铁和锰离子释放特性,有助于诱导铁死亡和激活 STING 信号通路。
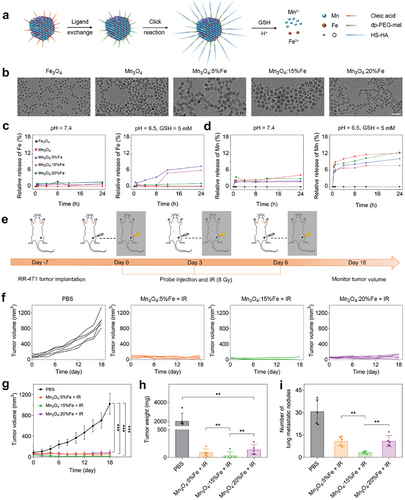
纳米颗粒的体内治疗效果
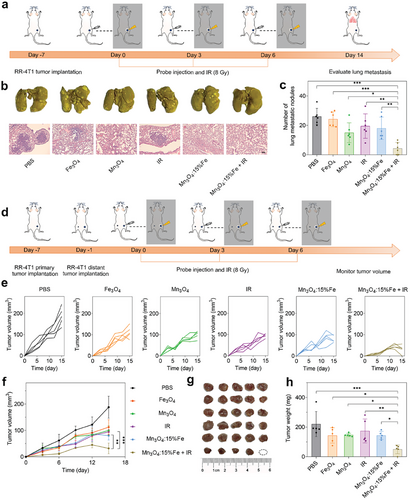
在 RR-4T1 小鼠模型中,Fe 掺杂 Mn3O4 纳米颗粒联合放疗显著抑制肿瘤生长和转移。与对照组相比,肿瘤体积和重量显著减小,肺部转移结节数量减少。此外,治疗组小鼠的 CD8+T 细胞浸润增加,MDSC 和 M2 巨噬细胞比例下降,表明免疫微环境得到显著改善。
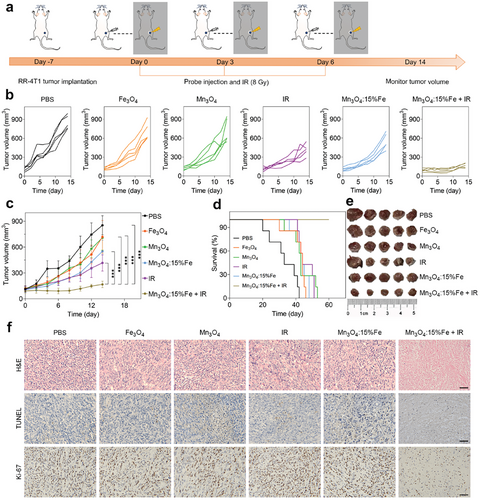
免疫微环境调控机制
进一步研究表明,Fe 掺杂 Mn3O4 纳米颗粒联合放疗显著降低肿瘤组织中 MDSC 和 M2 巨噬细胞比例,同时增加 CD8+T 细胞和 DC 成熟率。这些结果表明,该策略通过调控免疫微环境,有效克服放射抗性并增强抗肿瘤免疫反应。
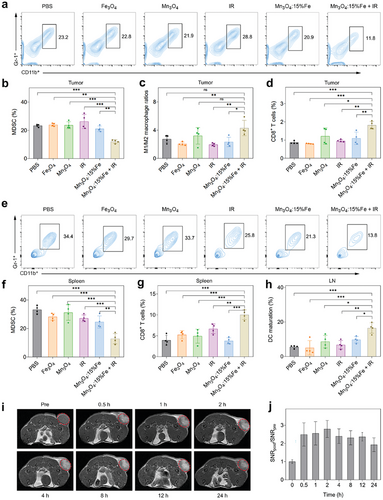
Fe/Mn 离子的协同作用机制
通过 ELISA 和免疫荧光染色等实验,验证了铁离子诱导的铁死亡和锰离子激活的 STING 信号通路的协同作用。结果显示,Fe 掺杂 Mn3O4 纳米颗粒联合放疗显著增加了肿瘤组织中的 4-HNE、IFN-α和 IFN-β水平,并显著增强了 DNA 损伤程度,表明其在消除放射抗性方面具有显著效果。
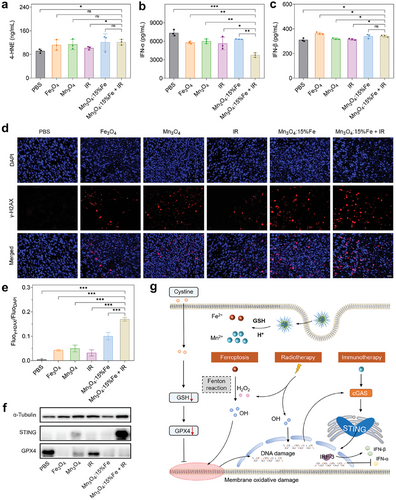
结论
Fe 掺杂 Mn3O4 纳米颗粒联合放疗通过诱导铁死亡和激活 STING 信号通路,有效克服了放射抗性并增强了肿瘤免疫反应。本研究为开发新型抗放射抗性策略提供了重要依据,具有潜在的临床应用价值。
参考文献
R. Zhang, M. Chen, H. Zhou, Y. Liu, Y. Wang, C. Chen, Y. Li, J. Zeng, J. Cui, R. Duan, M. Gao, Eliminating Radioresistance With a Magnetic Ion-Generator by Simultaneously Augmenting DNA Damage and Diminishing Immunosuppression. Adv. Mater. 2025, 2406378. https://doi.org/10.1002/adma.202406378