【Angew】新型的分支型α-淀粉酶活性标记探针,揭示淀粉降解酶的特异性
总结
研究开发了新型的活性标记探针,用于分析保留型α-淀粉酶的底物特异性。这些探针在纯蛋白、肠道微生物和堆肥样本中表现出高效的标记能力,揭示了α-淀粉酶在工业和健康中的应用潜力。
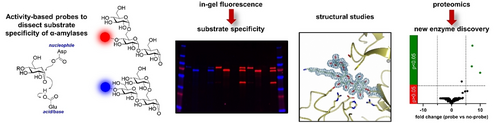
摘要
α-淀粉酶是淀粉降解的关键酶,广泛应用于工业和健康领域。然而,其功能特征的研究滞后于基因组学的发展。本文设计、合成并应用了新型的分支型α-淀粉酶活性标记探针,利用α-1,6分支和非分支的α-1,4麦芽二糖探针,探索了人类肠道微生物和工业相关α-淀粉酶的稳定性和底物特异性。通过在凝胶荧光和质谱分析中检测和注释α-淀粉酶的底物特异性,研究揭示了这些酶在复杂细胞裂解物中的作用。研究结果表明,这些探针能够快速功能性解析α-淀粉酶,有助于更好地选择和工程化用于工业应用的酶,同时也为人类健康中的酶分析提供了基础。
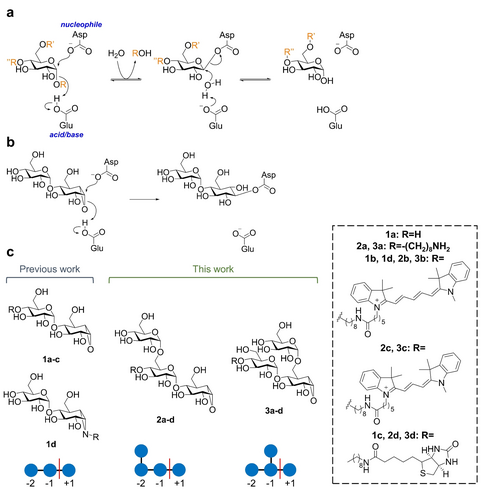
研究结果分类展示
探针合成与表征
- 合成方法:通过合成环氧化物抑制剂和活性标记探针,结合α-1,6葡萄糖分支点,生成2a和3a。
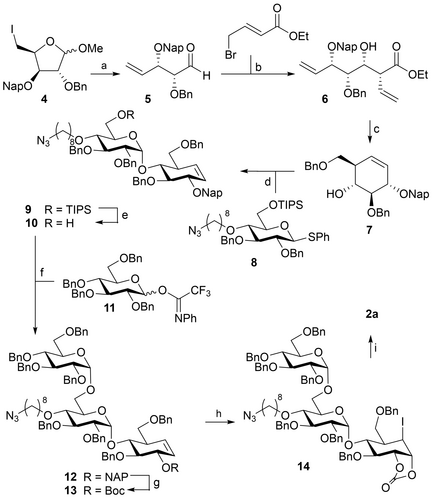
- 表征方法:利用荧光标记和质谱分析确认探针的特异性和稳定性。
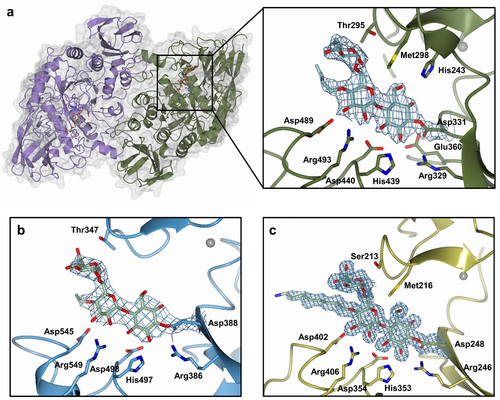
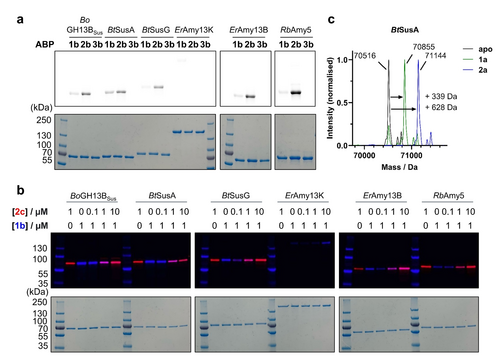
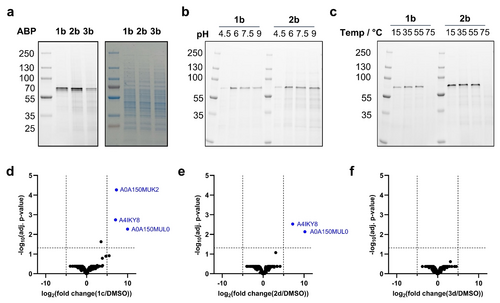
人类肠道细菌α-淀粉酶的底物特异性
- 实验设计:选择六种人类肠道细菌α-淀粉酶,使用1b、2b和3b探针进行标记实验。
- 结果分析:大多数酶对2b探针表现出更强的标记效果,表明其对分支底物的高亲和力。
工业α-淀粉酶的pH和温度依赖性
- pH依赖性:在pH 3到9范围内测试五种工业α-淀粉酶的活性,发现不同酶在不同pH值下表现出最佳活性。
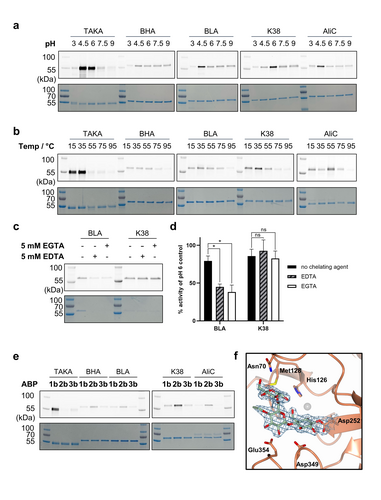
- 温度依赖性:在15到95°C范围内测试酶的热稳定性,结果显示BHA和BLA在高温下表现出较高的稳定性。
工业α-淀粉酶的钙依赖性
- 实验设计:在pH 10条件下使用EDTA和EGTA处理K38和BLA,测试其对钙离子的依赖性。
- 结果分析:K38对钙离子不敏感,而BLA在缺钙条件下活性显著降低。
工业α-淀粉酶的底物特异性
- 实验设计:使用1b、2b和3b探针测试五种工业α-淀粉酶的底物特异性。
- 结果分析:TAKA对麦芽二糖探针1b表现出最强的标记效果,而AliC对2b探针表现出更高的亲和力。
这项研究展示了新型活性标记探针在快速功能性解析α-淀粉酶中的巨大潜力,为工业应用和健康研究提供了新的工具和方法。详细信息可以在这里找到。
参考文献
Pickles, I. B.; Chen, Y.; Moroz, O.; Brown, H. A.; De Boer, C.; Armstrong, Z.; McGregor, N. G. S.; Artola, M.; Codée, J. D. C.; Koropatkin, N. M.; Overkleeft, H. S.; Davies, G. J. Precision Activity‐Based α‐Amylase Probes for Dissection and Annotation of Linear and Branched‐Chain Starch‐Degrading Enzymes. Angew Chem Int Ed 2024, e202415219. https://doi.org/10.1002/anie.202415219.