【Angew.Chem】3种关键机制揭秘人工细胞如何实现RNA信号传递与精准蛋白调控
人工细胞作为合成生物学的重要研究方向,正逐步从“模仿生命结构”迈向“复制生命功能”。近期发表于《Angewandte Chemie International Edition》的研究展示了一种新型光激活合成外泌体系统,成功实现了人工细胞与哺乳动物细胞之间的RNA信号传递。这项突破不仅拓展了人工细胞的通信能力,也为未来的精准治疗和生物工程应用提供了新思路。
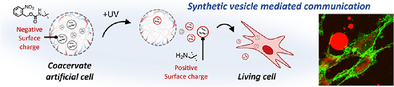
一、从小分子到RNA:人工细胞通信的进化
传统人工细胞通信方式多依赖小分子扩散,如酶级联反应或DNA信号。然而,真实生命系统中,RNA通过外泌体介导的方式在细胞间传递,具有更高的生物活性和调控能力。该研究首次将RNA信号引入人工细胞通信体系,模拟自然细胞间的核酸交流路径,迈出了人工细胞“类生命”功能的重要一步。
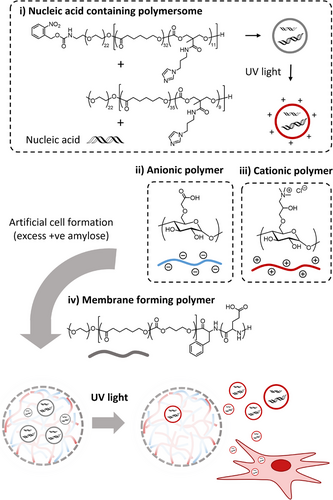
研究团队构建了一种模块化人工细胞系统,核心包括:
- 由淀粉衍生物形成的复合凝聚体(coacervate)模拟细胞质;
- 三聚物膜包裹形成半透结构,模拟细胞膜;
- 内部封装RNA的聚合物囊泡(polymersomes),具备光响应释放机制。
这种设计不仅实现了RNA的稳定封装与保护,还能通过光照控制其释放,实现时空精准调控。
二、3种关键机制,构建光激活RNA通信平台
1. 光响应聚合物囊泡的构建
研究者使用PEG-b-P(CL-co-TMC)嵌段共聚物,通过引入光可裂解的硝基苄胺基团,实现囊泡表面电荷的可控切换。具体步骤包括:
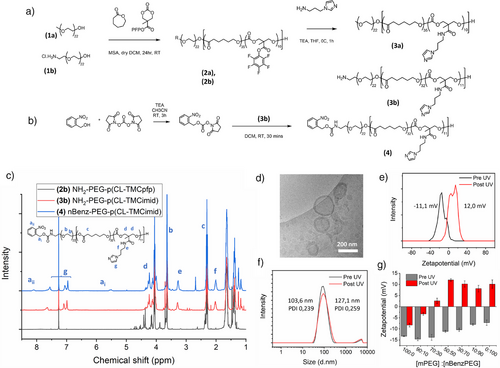
- 通过开环聚合合成含有五氟苯酯基团的聚合物;
- 与咪唑衍生物反应,引入RNA亲和性功能团;
- 最终修饰为光可裂解结构,形成稳定囊泡。
在365nm紫外光照射下,囊泡表面电荷由中性转为正电,促使其从人工细胞中释放,模拟自然外泌体的分泌过程。
2. RNA封装与释放效率验证
通过冷冻透射电子显微镜和动态光散射技术,研究者确认囊泡尺寸约为150nm,封装效率达34%(±5.7)。在人工细胞中,囊泡分布均匀,释放后仍保持完整结构,表明系统具备良好的稳定性与可控性。 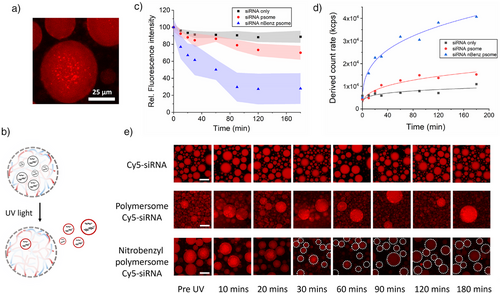
紫外照射10分钟后,囊泡释放至细胞外环境,荧光信号在3小时内下降至30%以下,远低于非响应对照组,验证了光控释放的有效性。
3. RNA信号传递与蛋白表达调控
研究进一步将人工细胞与HeLa细胞共培养,观察RNA信号的传递效果。结果显示: 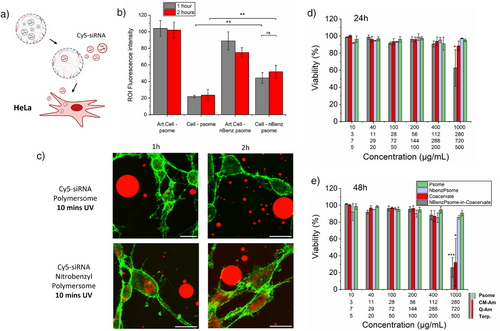
- 光照后1小时,细胞内荧光RNA信号增强2.1倍;
- 2小时后增强至2.3倍,表明囊泡成功被细胞摄取;
- 使用LAMP1-siRNA进行功能验证,蛋白表达抑制率最高达65%。
更令人惊喜的是,研究还实现了区域性光照控制,利用光掩膜仅照射部分细胞区域,成功实现局部蛋白表达抑制,模拟了组织特异性信号传递。 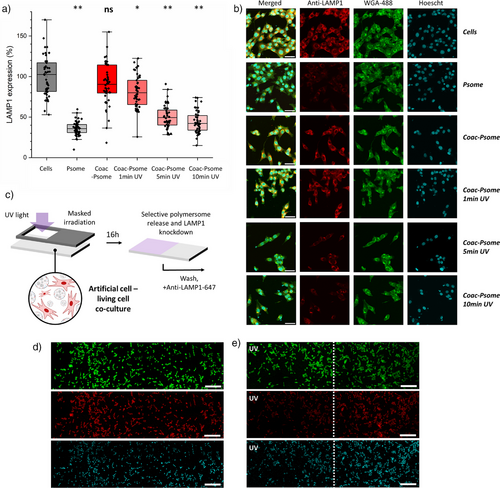
三、人工细胞通信的未来应用展望
该研究不仅展示了人工细胞与自然细胞之间RNA信号传递的可行性,更提供了一个可扩展的平台:
- 可替换RNA类型,如mRNA或CRISPR-Cas9,实现更复杂的基因调控;
- 可集成反馈回路,构建自主调节的人工细胞网络;
- 可用于疾病模型研究、药物筛选、甚至精准治疗。
相比传统DNA信号或蛋白因子传递,RNA具备更高的调控效率与生物兼容性。通过光控释放机制,研究者实现了对信号传递的时空精准控制,为人工细胞在复杂生物环境中的应用奠定了基础。
四、结语:人工细胞迈向“类生命”新纪元
这项研究标志着人工细胞通信能力的重大飞跃。通过构建光激活合成外泌体,研究者不仅实现了RNA信号的稳定封装与释放,还成功诱导了自然细胞的蛋白表达调控。未来,随着RNA类型与释放机制的不断优化,人工细胞有望在生物医学、合成生物学乃至智能材料领域发挥更大作用。
人工细胞,不再只是实验室中的微观模型,而是逐步走向具备“生命行为”的工程系统。我们正站在一个全新的起点,见证人工生命的崛起。