【Small】基于“多转子与多共轭”策略的高性能NIR-II菁染料用于成像引导的光热免疫治疗
摘要:
本研究报告了一种基于“多转子与多共轭”策略设计的新型近红外II区(NIR-II)菁染料分子(TPE-CyA) 。该分子展现出高达的摩尔消光系数、45.72%的光热转换效率(PCE)以及0.99%的荧光量子产率(FLQY) 。将其负载于DSPE-mPEG2000形成的纳米粒(TPE-CyA NPs),在保持高PCE(46.27%)的同时,实现了在4T1荷瘤小鼠模型中的高分辨率NIR-II荧光成像与血管造影 。在无任何外源免疫佐剂的条件下,单次TPE-CyA NPs给药结合1064 nm激光照射,不仅完全消融了原位肿瘤,还通过诱导免疫原性细胞死亡(ICD)激活了有效的全身抗肿瘤免疫应答,显著抑制了远端肿瘤生长和肝转移 。
1. 分子设计、合成与光物理性质
设计策略:
为解决传统NIR-II菁染料光热转换效率(PCE)与荧光量子产率(FLQY)难以平衡的难题,本研究采用了“多转子与多共轭”(multi-rotor & multi-conjugation)的设计思想 。通过在菁染料母核上引入不同数量的苯环作为分子内转子,合成了PH-CyA、TBE-CyA和TPE-CyA三个目标分子 。苯环的引入同时提供了共轭效应和转子特性 。增加的共轭体系旨在提升摩尔消光系数(MEC),而分子内旋转则促进了能量向非辐射跃迁路径耗散,从而增强PCE 。
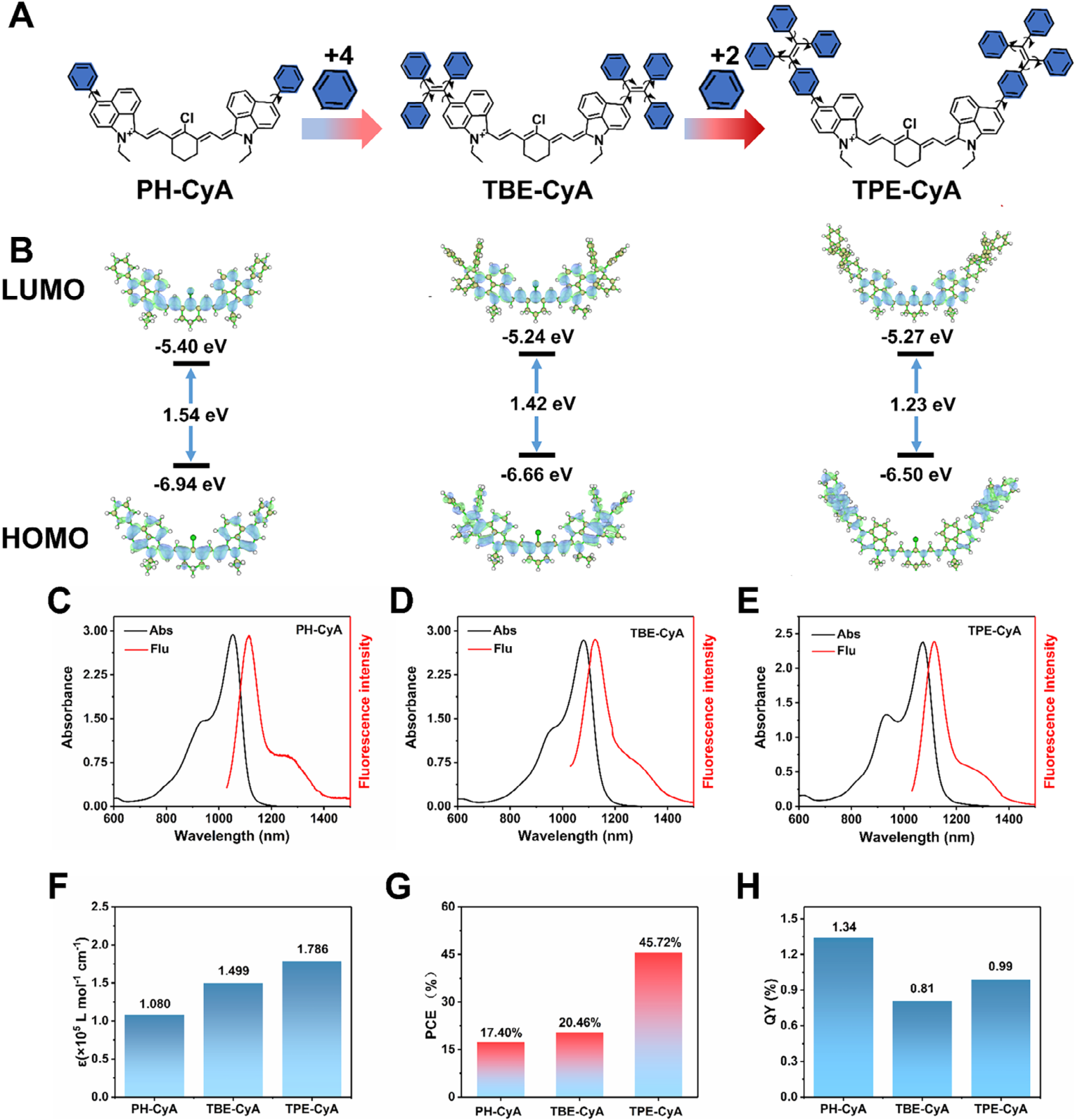
光物理性质表征:
吸收与发射: 三种分子均在900-1200 nm范围内有最大吸收峰,在1000-1400 nm范围内有最大发射峰 。
摩尔消光系数 (MEC): 随着苯环转子数量的增加,MEC值从PH-CyA的 1.08×105M−1cm−1 增加至TPE-CyA的 1.786×105M−1cm−1 。
PCE与FLQY: TPE-CyA分子在所有衍生物中表现出最优的性能平衡,其PCE达到45.72%,FLQY为0.99% 。密度泛函理论(DFT)计算显示,TPE-CyA的HOMO-LUMO能隙最低,为1.23 eV,这与其红移的吸收光谱相符 。
2. 纳米制剂的构建与体外性能评估
纳米粒制备与表征:
为提高生物相容性与水分散性,采用DSPE-mPEG2000将疏水性的TPE-CyA分子自组装成纳米粒(TPE-CyA NPs) 。
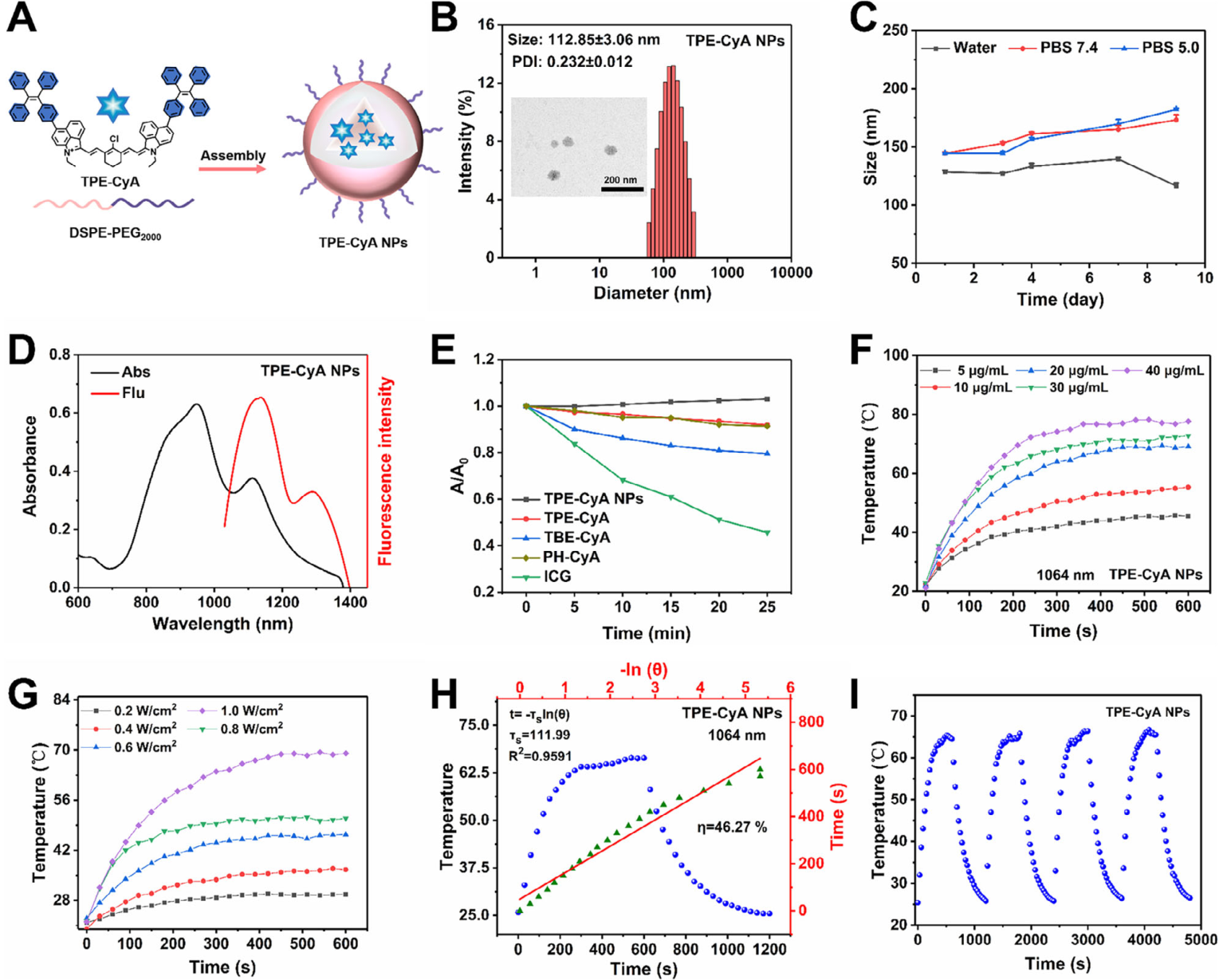
理化性质: 纳米粒平均粒径为112.85 nm,呈球形分散 。其PCE为46.27%,与游离分子基本持平 。FLQY为0.51%,轻微下降可能源于聚集诱导的淬灭效应 。
稳定性: TPE-CyA NPs在生理条件(PBS, pH 7.4)和酸性条件(pH 5.0)下均表现出良好的粒径稳定性 。光稳定性测试表明,经1064 nm激光持续照射25分钟后,其吸光度保留率为99.8%,远优于ICG(45.7%) 。
体外抗肿瘤与ICD诱导:
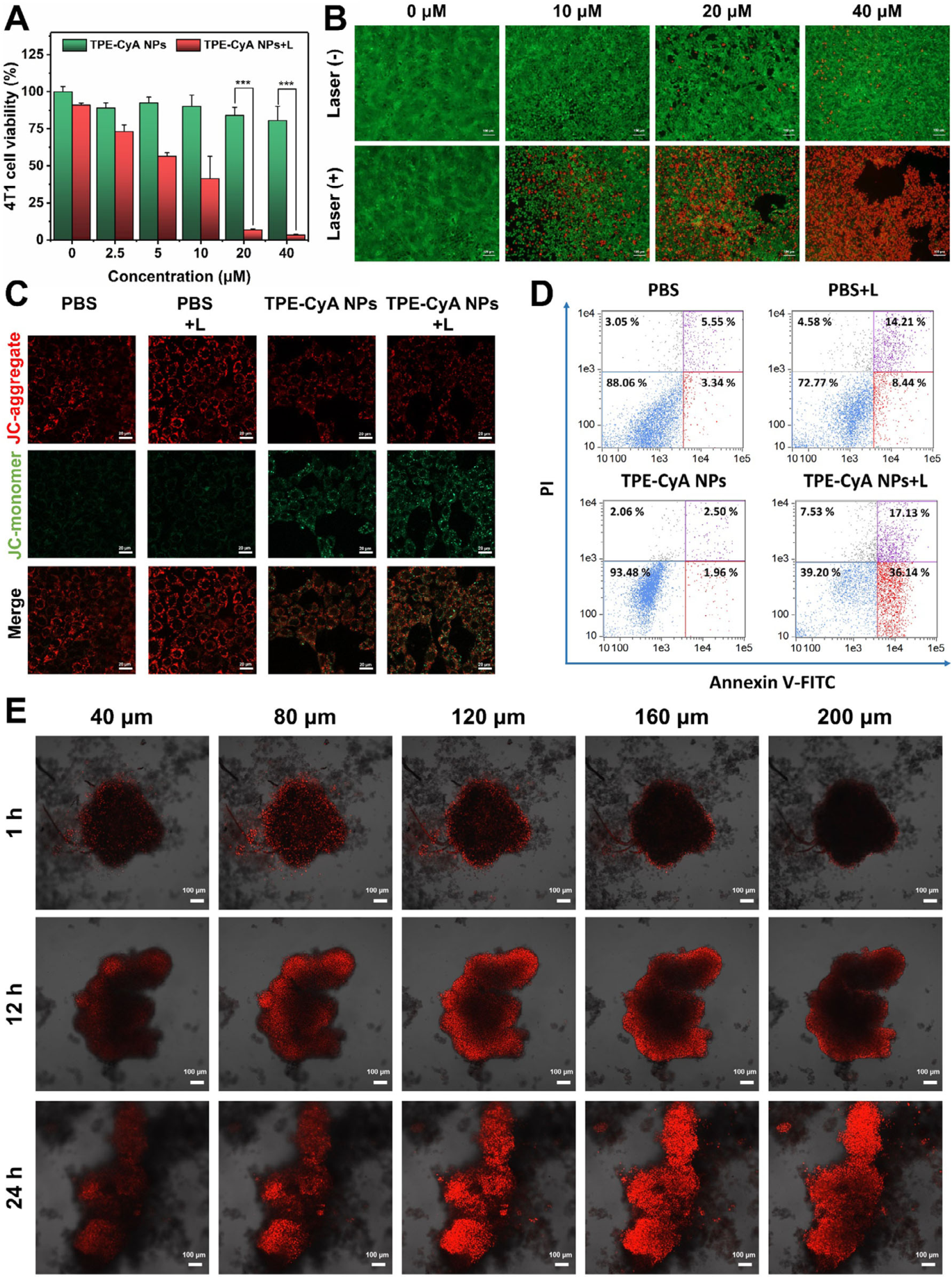
细胞毒性与光毒性: 在无光照条件下,TPE-CyA NPs对4T1细胞、HUVEC细胞和RAW264.7细胞均无明显毒性 。在1064 nm激光照射下,TPE-CyA NPs对4T1细胞表现出显著的浓度依赖性光毒性 。
细胞凋亡: Annexin V/PI流式细胞术分析显示,TPE-CyA NPs+激光组的细胞凋亡率(早期+晚期)高达53.27% 。JC-1染色证实该过程涉及线粒体膜电位的耗散 。
3D肿瘤球模型: TPE-CyA NPs能在24小时内穿透至200 µm深度的4T1肿瘤球内部,并在光照下有效瓦解肿瘤球结构 。
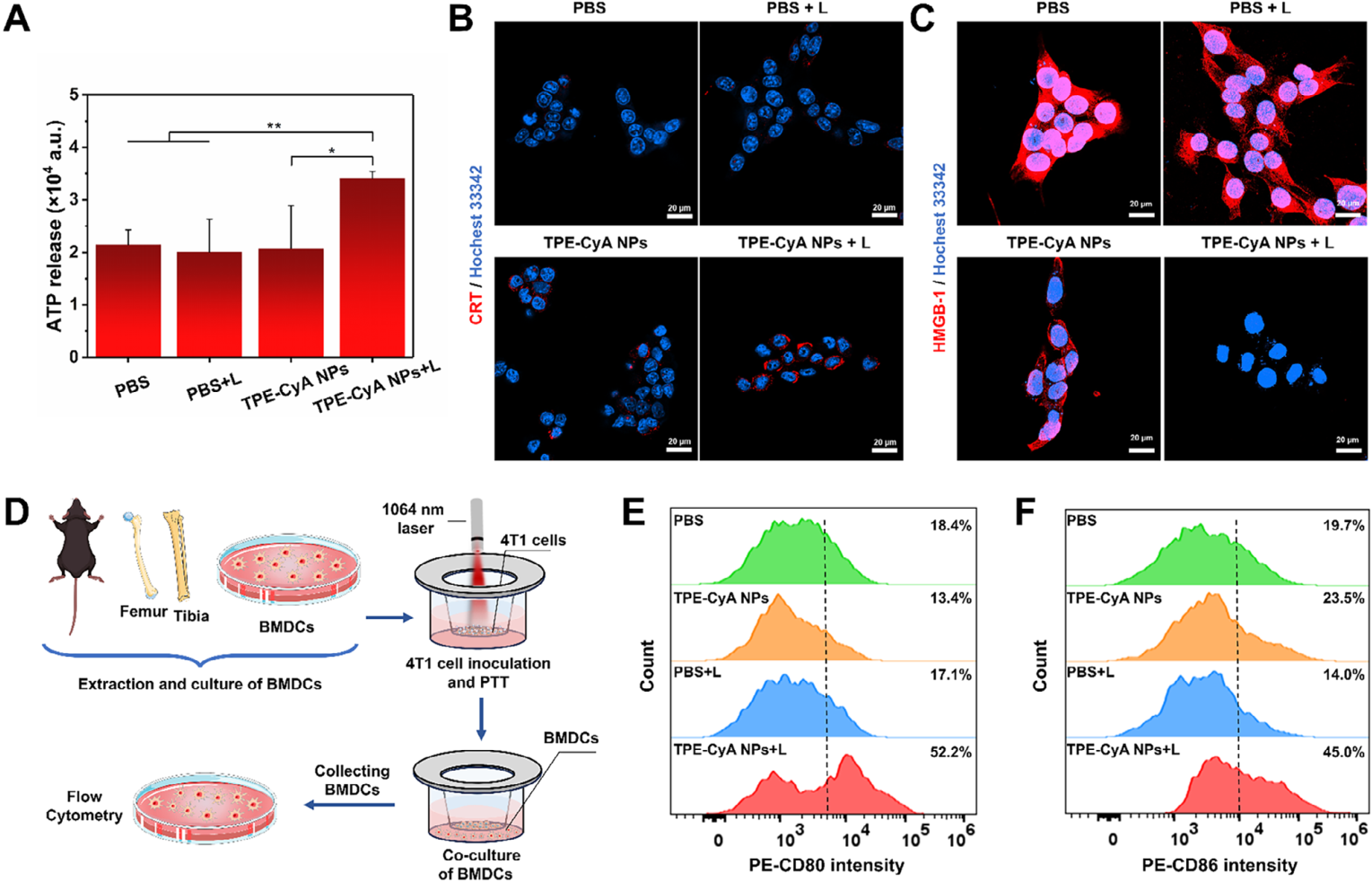
免疫原性细胞死亡 (ICD): 体外实验证实,TPE-CyA NPs介导的光热治疗能够有效诱导4T1细胞发生ICD。关键DAMPs标志物,包括细胞外ATP释放量增加、钙网蛋白(CRT)的细胞膜暴露以及高迁移率族蛋白B1(HMGB-1)从细胞核释放均显著上调 。
DC细胞成熟: 将经过不同处理的4T1细胞与小鼠骨髓来源的树突状细胞(BMDCs)共培养,流式分析结果显示,TPE-CyA NPs+激光组能显著促进DC细胞表面共刺激分子CD80和CD86的表达,表明其有效促进了DC细胞的成熟 。
3. 体内成像引导的光热免疫治疗
药代动力学与NIR-II成像:
肿瘤富集: 静脉注射TPE-CyA NPs后,通过NIR-II荧光成像(激发:1064 nm,发射:>1150 nm)监测,发现药物在4T1皮下瘤内的荧光信号在12小时达到峰值,此时信噪比(SNR)为2.41 。
生物分布与清除: 24小时后,荧光信号主要分布于肝脏和肾脏,表明药物主要通过肝肾途径代谢清除 。
血管造影: TPE-CyA NPs可作为造影剂,清晰显示小鼠背部和足部直径为434.54 µm和352.46 µm的血管结构,展示了其高分辨率深层组织成像的潜力 。
单发肿瘤模型治疗:
在4T1单发皮下瘤模型中,单次静脉注射TPE-CyA NPs (6 mg kg−1) 并在12小时后进行1064 nm激光照射(1.0 W cm−2, 10 min),肿瘤局部温度可达53.5∘C 。治疗14天后,治疗组肿瘤被完全清除,肿瘤抑制率达100% 。 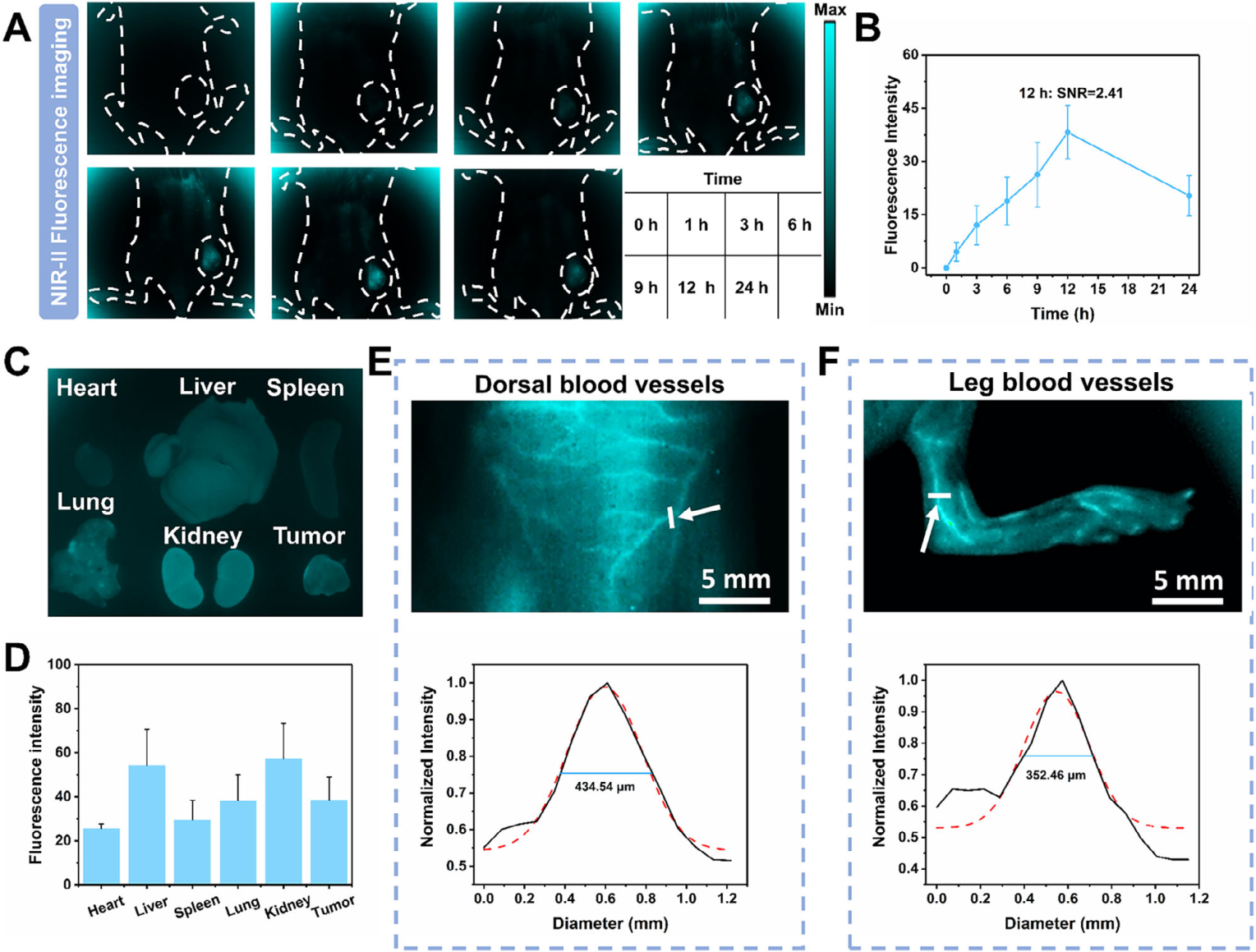
双侧肿瘤模型的“远端效应” (Abscopal Effect):
治疗方案: 在BALB/c小鼠双侧4T1肿瘤模型中,仅对右侧原位瘤进行激光照射(0.8 W cm−2),左侧远端瘤不作处理 。
结果: 治疗组不仅原位瘤生长受到显著抑制,其远端瘤的生长同样被有效遏制,证明了该疗法诱导了强烈的全身性抗肿瘤免疫应答 。
免疫机制验证: 免疫荧光染色显示,治疗组的原位瘤和远端瘤组织中,均观察到CRT的暴露和HMGB-1的核释放,以及CD80+、CD86+ DC细胞的显著增加 。同时,CD4+和CD8+ T细胞在两种肿瘤中的浸润水平均大幅提高 。
细胞因子水平: 血清学检测表明,治疗组小鼠体内的促炎细胞因子TNF-α, IFN-γ, 和IL-12的浓度显著高于对照组 。
转移抑制: H&E染色结果证实,该疗法有效抑制了4T1肿瘤的自发性肝转移 。
4. 作用机制的转录组学分析
为深入探究其内在分子机制,研究人员对原位瘤和远端瘤组织进行了RNA测序(RNA-seq)分析 。
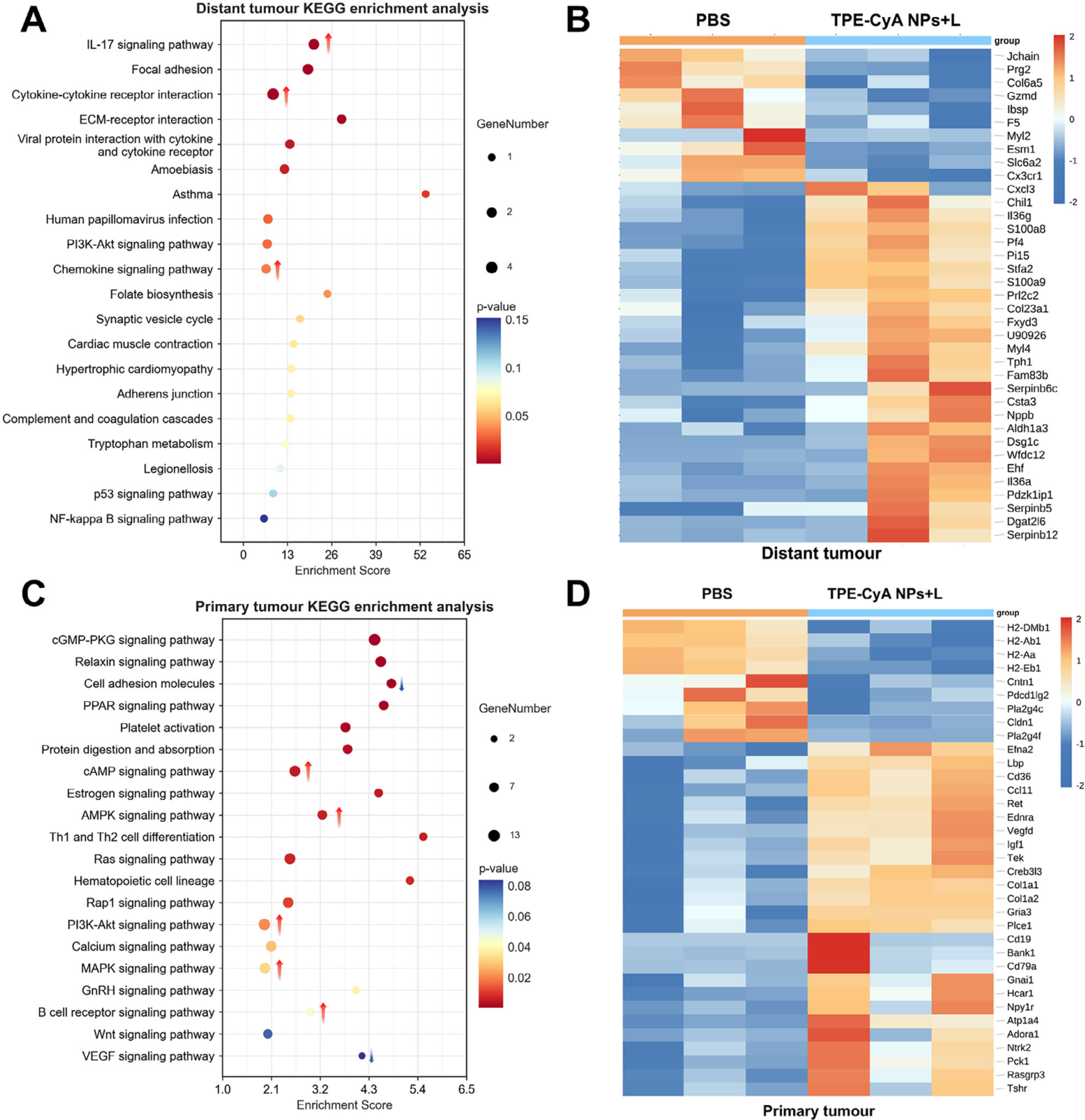
原位瘤: KEGG富集分析显示,治疗组原位瘤中与细胞增殖、分化和凋亡相关的信号通路(如AMPK, PI3K-Akt, MAPK)以及B细胞受体信号通路被显著上调,而与血管生成相关的通路(如VEGF, 细胞粘附分子)被下调 。这表明光热效应直接诱导细胞凋亡,并破坏肿瘤血管,协同抑制肿瘤生长 。
远端瘤: 远端瘤的KEGG分析则显示,免疫相关的信号通路,如细胞因子-细胞因子受体相互作用、趋化因子信号通路以及IL-17信号通路等被显著上调 。这从基因层面证实了远端效应是由激活的全身免疫应答所介导的。
结论
本研究成功地通过“多转子与多共轭”策略,开发了一种具有超高摩尔消光系数和均衡光物理特性的NIR-II菁染料TPE-CyA。其纳米制剂TPE-CyA NPs作为一种高效的“诊疗一体化”平台,实现了高分辨率的NIR-II成像引导下的光热治疗。尤为重要的是,该疗法无需联合免疫检查点抑制剂或免疫佐剂,即可通过诱导ICD,有效激活全身的适应性免疫反应,从而在消融原位肿瘤的同时,实现了对远端肿瘤和转移灶的有效控制,为开发新一代肿瘤光热免疫疗法提供了极具价值的分子工具和策略参考。