【Angew.Chem】82纳秒长寿命!钌配合物实现近红外吸收与高效Type-I光动力治疗突破
钌(II)配合物在光动力治疗(PDT)领域的应用近年来备受关注,尤其是在肿瘤低氧环境下的Type-I PDT策略。本文报道了一种新型环金属化钌配合物Λ/Δ-Ru-TPABP,不仅实现了近红外(NIR)区域的强吸收,还展现出罕见的长寿命激发态(达82纳秒),在体内外均表现出卓越的抗肿瘤效果。以下是该研究的详细总结,适合科普传播与公众号发布。 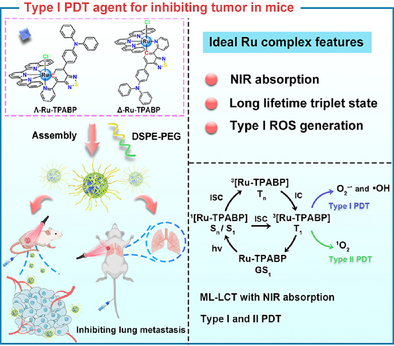
📚文章标题:Cyclometalating Ligand Affords NIR Absorption in Ruthenium Complexes for Type-I Photodynamic Therapy 作者:Zongwei Zhang等 期刊:Angew. Chem. Int. Ed链接:https://doi.org/10.1002/anie.202512296
一、研究背景:钌配合物的光动力潜力与挑战
钌(II)配合物因其独特的激发态性质,被广泛研究用于PDT。传统的Ru(bpy)₃²⁺类配合物主要通过Type-II机制生成单线态氧(¹O₂),但在肿瘤低氧环境中疗效受限。相比之下,Type-I机制通过电子转移生成羟自由基(·OH)和超氧阴离子(O₂⁻•),更适用于低氧条件。然而,实现Type-I机制的钌配合物仍面临三大挑战:
- 吸收波长需红移至NIR区域以实现深层组织穿透;
- 激发态寿命需足够长以促进电子转移;
- 配合物需具备合适的氧化还原电位以高效生成ROS。
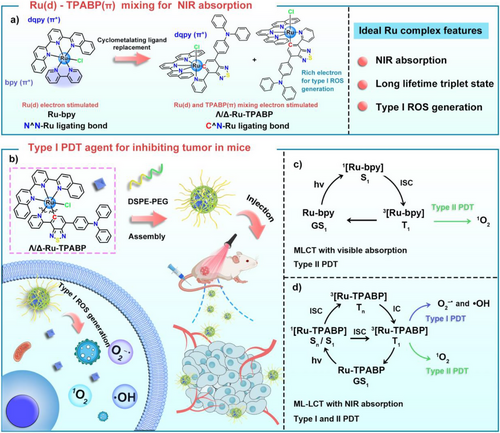
二、分子设计:环金属化配体TPABP的引入
研究团队设计了Λ/Δ-Ru-TPABP配合物,采用以下策略:
- 使用强电子供体的环金属化配体TPABP(含三苯胺结构);
- 搭配多吡啶配体dqpy,构建Ru(d)和TPABP(π) → dqpy(π*)的金属-配体-配体电荷转移(ML–LCT)通道;
- 通过分子轨道重组实现吸收峰红移至640 nm,吸收尾延伸至800 nm。
该设计有效缩小HOMO-LUMO能隙,增强NIR吸收能力。
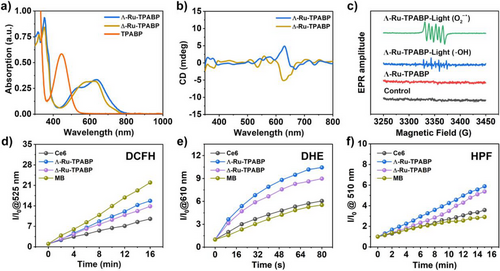
三、光物理性质:激发态寿命达82纳秒
通过飞秒瞬态吸收(fs-TA)和纳秒瞬态吸收(ns-TA)光谱分析,Λ/Δ-Ru-TPABP展现出以下特性: 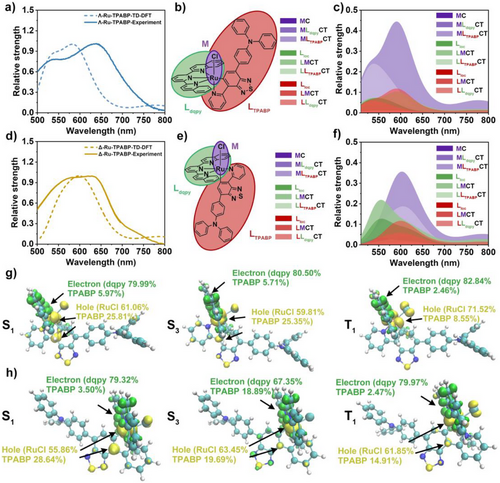
- 激发态T₁形成时间约为30皮秒;
- T₁态寿命达82纳秒(在氮气保护的二氯甲烷中),远超传统环金属化钌配合物(一般为0.1–10 ns);
- 显著增强的激发态寿命有利于ROS生成,提升PDT效率。
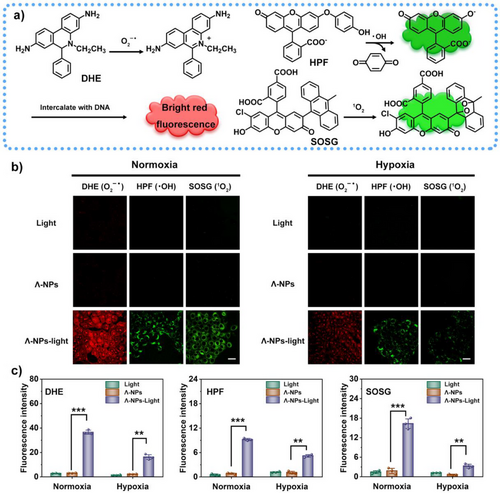
四、ROS生成能力:Type-I机制优势显著
通过EPR、DCFH、DHE和HPF等探针检测,Λ/Δ-Ru-TPABP在700 nm光照下展现出强烈的Type-I ROS生成能力: 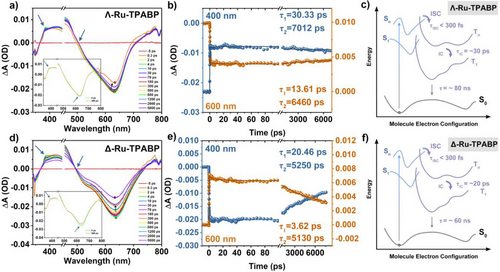
- O₂⁻•和·OH的生成效率分别为Ce6的10.44/8.98倍和5.88/5.38倍;
- 总ROS生成能力为Ce6的1.64/1.45倍;
- 与传统Type-I光敏剂甲基蓝相比,Λ/Δ-Ru-TPABP在O₂⁻•和·OH生成方面更具优势。
五、纳米递送系统:提高肿瘤靶向性与生物相容性
为提升体内应用效果,研究团队将Λ/Δ-Ru-TPABP封装入DSPE-PEG2000构建的纳米粒子中:
- 纳米粒子尺寸适中,水溶性良好;
- 在4T1乳腺癌细胞中实现高效内吞;
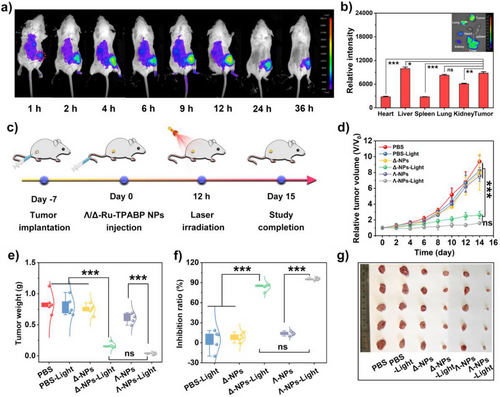
- 在体内注射后12小时达到肿瘤部位最大富集,适合作为光照时间点。
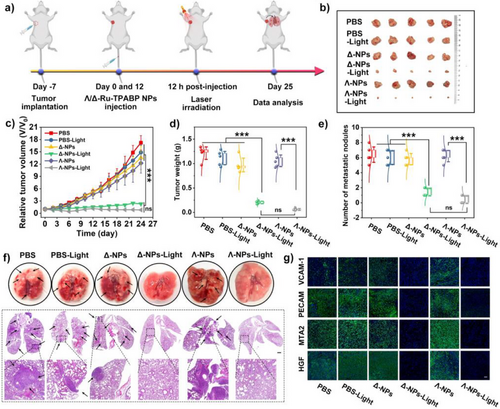
六、体内外抗肿瘤效果:肿瘤抑制率高达95.31%
在体外细胞实验中,Λ/Δ-Ru-TPABP纳米粒子展现出以下特性:
- 在黑暗条件下无明显毒性(IC₅₀ > 120 µM);
- 在光照下表现出强烈光毒性(IC₅₀ < 0.34 µM);
- 在低氧环境下仍保持高效杀伤能力,Type-I机制优势明显。
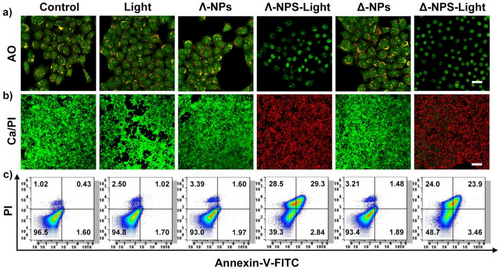
在小鼠乳腺癌模型中,单次治疗后:
- 肿瘤体积增长显著抑制(V/V₀仅为1.62);
- 肿瘤抑制率达95.31%;
- 肺部转移结节显著减少(仅0–2个);
- 相关转移蛋白表达(VCAM-1、PECAM-1、MTA2、HGF)显著下调;
- 无明显毒副作用,生物相容性良好。
七、结语:三大突破引领钌基Type-I PDT新纪元
本研究在钌配合物PDT领域实现了三大关键突破:
- 首次实现钌配合物在NIR区域(640–800 nm)强吸收;
- 激发态寿命达82纳秒,为Type-I电子转移提供充足时间窗口;
- 在低氧肿瘤环境中展现出卓越的抗癌效果与转移抑制能力。
Λ/Δ-Ru-TPABP的成功设计为未来开发高效、低氧适应型光敏剂提供了重要参考,也为钌基PDT药物的临床转化奠定了坚实基础。