【Angew.Chem.】52.3%载药效率!磷脂-药物共轭物自组装纳米管开启精准抗癌新纪元
在精准药物递送领域,如何实现高效、稳定、靶向性强的载药系统一直是科研热点。近日,《Angewandte Chemie》发表的一项研究突破了传统脂质体的局限,报道了一类新型磷脂-药物共轭物(PCCs),可自组装形成结构明确的超分子纳米管,不仅具备高达52.3%的载药效率,还展现出对肿瘤细胞20至50倍的选择性毒性,为抗癌治疗提供了全新策略。 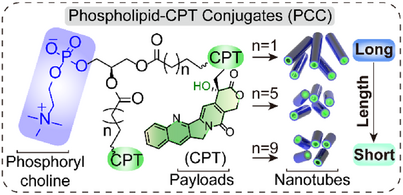
📚文章标题:Phospholipid-Drug Conjugates Self-Organized into Well-Defined Supramolecular Nanotubes for Efficient Drug Delivery 作者:Zhiguo Gao等 期刊:Angew. Chem. Int. Ed链接:https://doi.org/10.1002/anie.202509799
一、背景:从脂质体到纳米管,药物递送的结构革命
传统脂质体因其良好的生物相容性和包载能力被广泛用于药物递送,但其球形结构在细胞摄取、循环时间等方面存在局限。相比之下,纳米管状结构因其高纵横比和稳定性,在体内表现出更优的药代动力学特性。 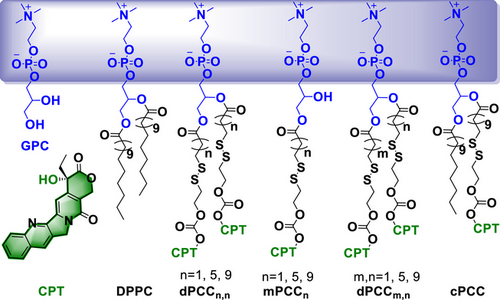
本研究以磷脂为基础,通过将平面结构的抗癌药物喜树碱(CPT)共轭至磷脂尾链,成功诱导其在水溶液中自组装形成一维纳米管结构,突破了脂质体只能形成球形的传统认知。
二、分子设计:链长调控实现结构可控
研究团队设计了多种PCCs分子,分别在磷脂尾链上连接一个或两个CPT基团,并系统调控碳链长度: 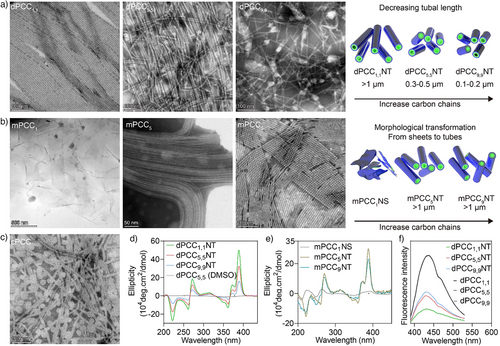
- 双链型dPCC(如dPCC 1,1、5,5、9,9)在水中自组装形成纳米管,长度从微米级逐渐缩短至纳米级;
- 单链型mPCC(如mPCC 1、5、9)则表现出不同的自组装行为,mPCC 1形成二维纳米片,mPCC 5和9形成微米级纳米管;
- 控制组cPCC仅连接一个CPT基团,形成混合结构,包括球形脂质体和纳米管。
通过圆二色谱(CD)和紫外吸收分析,研究发现CPT之间的π–π堆积是形成纳米管的关键驱动力,碳链越短,堆积越有序,纳米管越长。
三、模拟验证:分子动力学揭示组装机制
为进一步理解自组装过程,研究者进行了长时间粗粒度分子动力学(CG-MD)模拟: 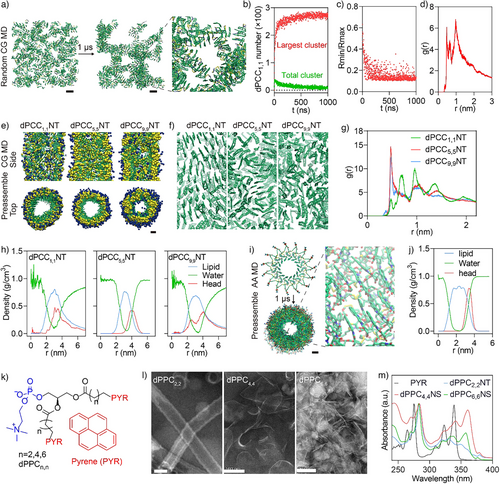
- 300个dPCC分子在水中随机分布,1微秒内快速聚集形成稳定纳米管;
- CPT基团之间的距离逐渐趋于稳定,形成有序堆积;
- 纳米管呈现单分子层结构,直径约8 nm,与实验结果高度一致;
- RDF分析显示随着时间推移,CPT堆积呈现长程有序性,验证了纳米管的晶体样排列。
此外,研究还将CPT替换为其他平面分子如芘(PYR),成功构建了双层壁纳米管和二维纳米片,证明该策略具有广泛的结构适应性。
四、生物性能:高载药、高选择性、可控释放
PCC纳米管在药物递送方面展现出多项优势: 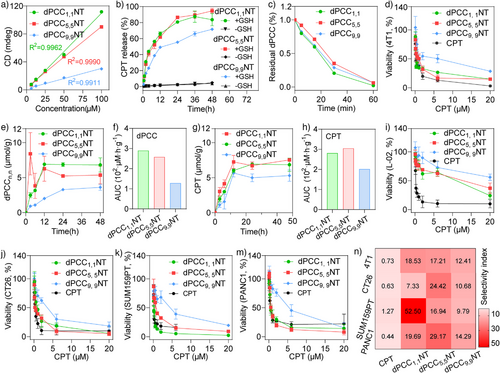
- 载药效率高:dPCC纳米管的CPT载药量高达43.9%至52.3%,远超传统ADC(抗体药物偶联物)的4–8%;
- 稳定性强:在血浆中24小时保持清澈,无明显蛋白吸附或聚集;
- 响应性释放:在10 mM谷胱甘肽(GSH)环境下,8小时释放约50%,24小时完全释放;
- 细胞毒性强:对4T1乳腺癌细胞的IC₅₀值与游离CPT相当,而对正常肝细胞毒性显著降低,选择性指数提高20–50倍;
- 长度依赖性明显:中等长度(0.3–0.5 µm)的dPCC 5,5 NT表现出最佳的细胞摄取和毒性效果。
五、体内表现:安全性高,肿瘤靶向性强
在小鼠模型中,dPCC纳米管展现出优异的药代动力学和安全性: 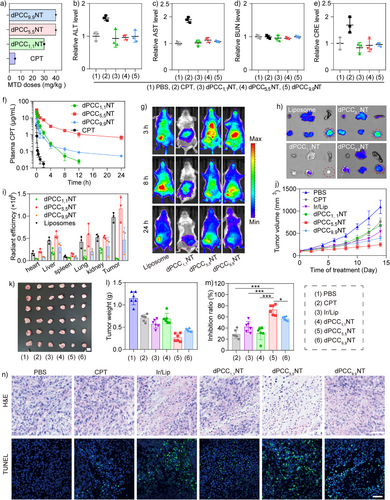
- 最大耐受剂量(MTD):dPCC 1,1、5,5、9,9分别为30、40、40 mg/kg,远高于游离CPT的5 mg/kg;
- 血液循环时间:dPCC 5,5 NT半衰期达21.92小时,远超其他组;
- 肿瘤富集能力强:Cy5.5标记的dPCC 5,5 NT在肿瘤部位信号最强,优于脂质体;
- 抗肿瘤效果显著:在4T1肿瘤模型中,dPCC 5,5 NT抑瘤率达73%,远高于游离CPT(29%)和脂质体(42%);
- 组织毒性低:肝肾功能指标正常,主要器官无明显病理变化。
六、联合治疗:CSC靶向能力提升治疗效果
为应对癌症干细胞(CSC)引发的耐药性,研究者将全反式维甲酸(ATRA)共载入dPCC 5,5 NT中: 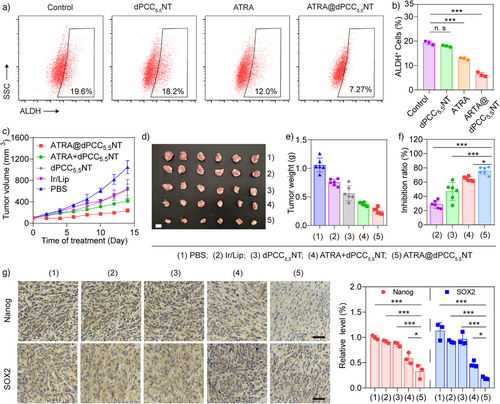
- ATRA@dPCC 5,5 NT载药量达15.3%,显著降低CSC标志物ALDH和SCA-1表达;
- 在CSC富集肿瘤模型中,抑瘤率达75.9%,优于单独或顺序给药;
- 免疫组化显示干细胞相关蛋白Nanog和SOX2显著下调,表明干性被有效抑制。
七、结语:纳米管结构开启非球形载药新时代
本研究首次实现了磷脂-药物共轭物在水中自组装形成结构明确的纳米管,并通过碳链长度调控其尺寸和生物性能。相比传统脂质体和ADC,PCC纳米管具备以下优势:
- 单分子构建,制备简便;
- 高载药量,释放可控;
- 结构稳定,靶向性强;
- 可拓展至其他平面分子,具备广泛应用潜力。
未来,PCC纳米管有望在肿瘤治疗、免疫调节、光敏治疗等领域发挥更大作用,推动非球形纳米载体的临床转化。
如需将本文改编为图文排版、视频脚本或FAQ形式,我可以继续协助。是否希望我为这篇文章设计一个互动式结尾或读者提问环节?