【Angew.Chem】🔬突破性荧光探针:揭秘丙酮酸激酶调节的「37纳米」秘密
丙酮酸激酶(Pyruvate Kinase, PK)作为糖酵解末端的关键酶,近年来在癌症、糖尿病及代谢疾病研究中备受关注。然而,针对其异构体(尤其是肝脏型PKL)的变构调节机制,长期缺乏高效的细胞内靶点结合检测工具。本文介绍了一种新型荧光探针——LumiPK,其结合能力高达37±5 nM,填补了PKL靶点结合技术的空白,为药物筛选和机制研究提供了强有力的工具。 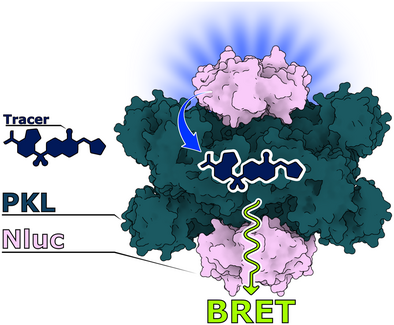
🧬一、背景:丙酮酸激酶为何重要?
丙酮酸激酶催化磷酸烯醇丙酮酸(PEP)转化为丙酮酸,并生成ATP,是糖酵解的终点反应。人体中存在四种PK异构体:
- PKL:主要在肝脏表达
- PKR:红细胞中表达
- PKM1:肌肉和脑组织
- PKM2:增殖细胞和胚胎组织中表达
这些异构体通过变构调节机制响应内源性代谢物(如果糖1,6-二磷酸)或外源性小分子调节剂,从而调控细胞能量代谢。尤其在癌症和代谢疾病中,PK的活性变化与病理过程密切相关。
💡二、技术瓶颈:变构调节剂的靶点验证难题
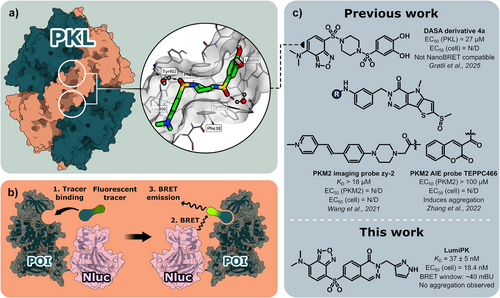
尽管已有多种PK调节剂问世,如Mitapivat、TEPP-46和DASA-58,但验证其在细胞内是否真正结合PKL的变构位点仍是挑战。传统方法如热转移、蛋白质组学或FRET等,存在操作复杂、通量低或特异性差的问题。 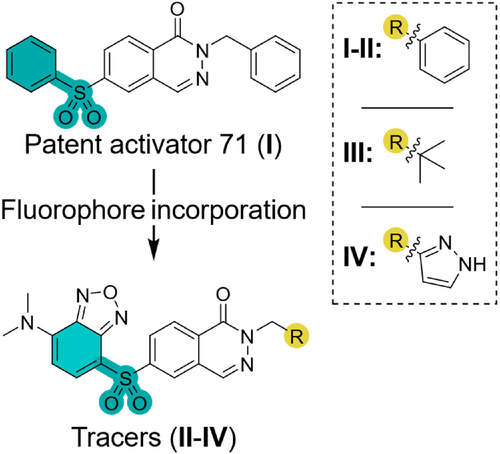
NanoBRET技术因其高通量、低资源需求而受到青睐,但此前尚无针对PKL的NanoBRET系统,主要受限于缺乏高亲和力的荧光探针。
🌟三、LumiPK的诞生:从设计到验证
研究团队以专利中的Phthalazine类激动剂为基础,设计了四种荧光探针(I–IV),其中LumiPK(IV)表现最优。其核心设计包括: 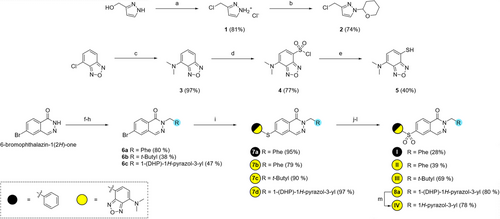
- 将环境敏感型SBD荧光团直接嵌入配体骨架
- 通过结构优化提升亲和力和细胞通透性
- 采用晶体结构验证其与PKL变构位点的结合模式
🔬关键数据:
- LumiPK对PKL的结合常数:KD = 37±5 nM
- 细胞内NanoBRET实验EC50:18.4 nM
- 对PKM2的选择性:约37倍
- 与PKL四聚体专一结合,不与单体或二聚体结合
🧪四、实验验证:从体外到活细胞
研究采用多种方法验证LumiPK的性能:
1. 表面等离子体共振(SPR)
- LumiPK与PKL结合紧密,解离速率快于Mitapivat
- 与PKM2结合较弱,体现良好选择性
2. 荧光滴定与竞争实验
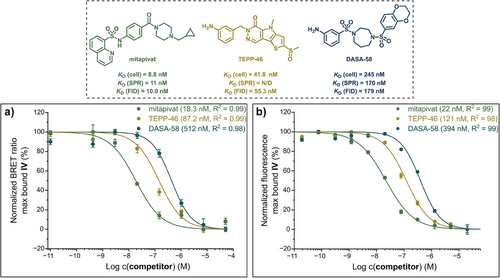
- 与Mitapivat、TEPP-46、DASA-58竞争结合,结果与SPR一致
- 可用于筛选新型变构调节剂
3. 活细胞成像与NanoBRET
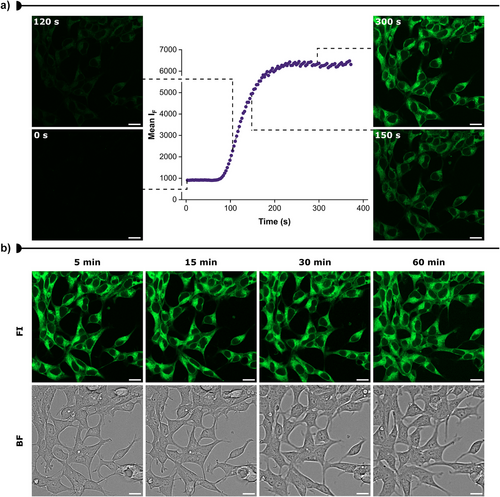
- HEK293细胞快速摄取LumiPK,4分钟内达稳定信号
- 荧光信号稳定,光稳定性良好
- 不影响细胞活性,适合活细胞实验
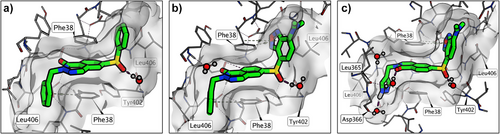
🧬五、结构解析:晶体学揭示结合机制
X射线晶体结构显示:
- LumiPK与PKL变构位点形成多个水介导氢键
- Pyrazole基团与Phe38形成π–π相互作用
- 结合构象稳定,有助于高亲和力
此外,Native PAGE实验进一步证实LumiPK仅与PKL四聚体结合,强调其结构选择性。 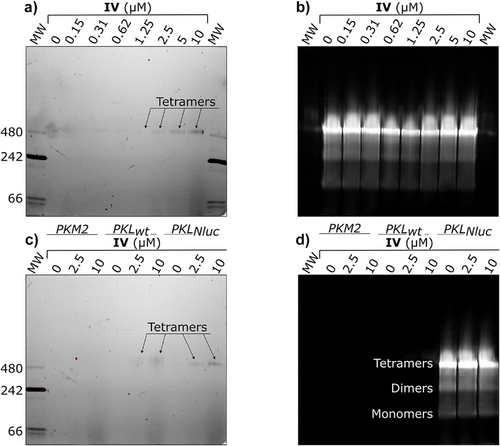
🚀六、应用前景:开启高通量筛选新纪元
LumiPK的成功开发不仅填补了PKL靶点结合检测的技术空白,还具备以下潜力: 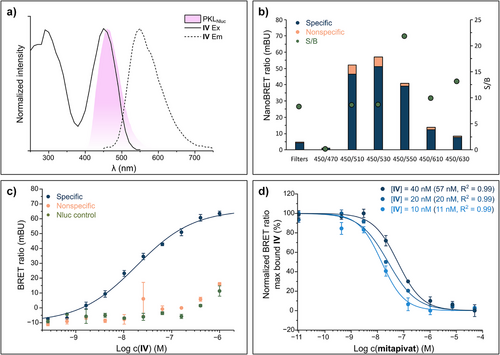
- 构建高通量NanoBRET筛选平台
- 用于药物机制验证与优化
- 拓展至其他PK异构体的探针开发
- 支持代谢疾病和癌症研究中的靶点验证
🎯结语:一个37纳米的突破,连接代谢与药物研发
LumiPK的出现,标志着变构调节剂研究进入精准检测时代。其高亲和力、细胞通透性和结构选择性,使其成为研究PKL调节机制的理想工具,也为未来开发新型代谢调节药物提供了坚实基础。
在代谢调控的迷宫中,LumiPK如同一盏荧光灯,照亮了37纳米的关键通道。
【原文链接】可参考 Wiley期刊页面 获取完整研究内容。
文章信息
📚文章标题:Potent Fluorescent Probe for Target-Engagement Studies of Allosteric Pyruvate Kinase Modulators 作者:O. Nilsson, A. P. Valaka, L. Håversen, A. Bogucka, I. Köteles, P. Brear, M. Rutberg, A. Gunnarsson, M. Hyvönen, M. Grøtli 期刊:Angew. Chem. Int. Ed 链接:https://doi.org/10.1002/anie.202513969