【Adv.Mater.】突破亮度瓶颈!两大策略打造117.5 M⁻¹cm⁻¹超亮NIR-II荧光材料
近红外二区(NIR-II, 900–1700 nm)荧光成像技术因其低自发荧光背景、深组织穿透力和高空间分辨率,正在迅速改变生物医学成像的格局。然而,实现高亮度的NIR-II分子荧光探针仍面临巨大挑战,尤其是在分子聚集态下同时保持高吸收系数与高荧光量子效率。本文提出“分子锁定”和“分子包裹”双重策略,成功开发出亮度高达117.5 M⁻¹cm⁻¹的DETTD纳米颗粒,为体内高分辨率成像提供了强有力的工具。 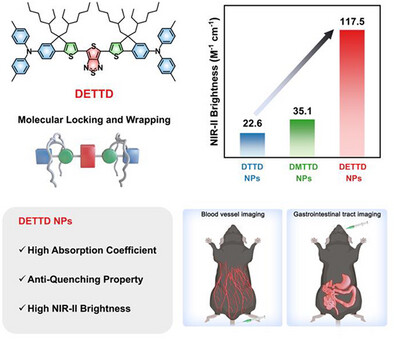
🌟一、NIR-II成像的优势与挑战
NIR-II荧光成像技术具有以下显著优势:
- 低背景干扰:组织在该波段的自发荧光极低,有利于提高信噪比。
- 深层穿透能力:可穿透数毫米至厘米级组织,适用于深部器官成像。
- 高空间分辨率:散射减少,成像更清晰。
但要实现这些优势,关键在于开发具有高亮度的荧光材料。亮度由吸收系数与荧光量子效率(QY)共同决定,而传统有机小分子在聚集态下常因π-π堆积导致荧光猝灭,严重限制其应用。
🧪二、三步合成策略:从DTTD到DETTD
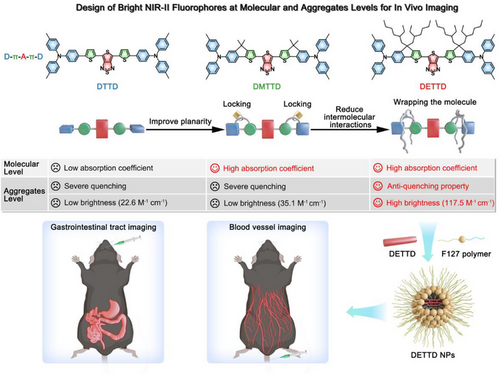
研究团队设计了三种具有D-π-A-π-D结构的分子:
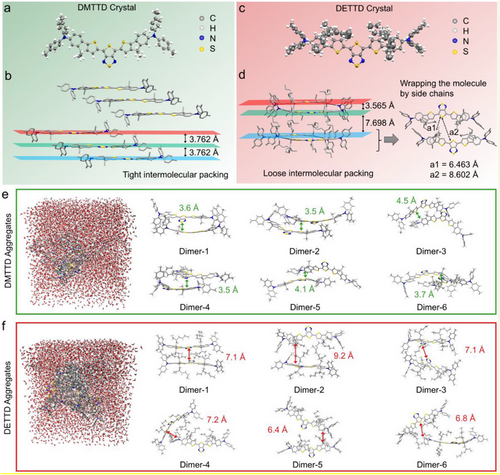
- DTTD:初始结构,分子骨架扭曲,吸收系数低,聚集态下荧光猝灭严重。
- DMTTD:通过“分子锁定”策略,将供体苯环与桥接噻吩锁定,骨架平面化,吸收系数提升至3.57 × 10⁴ M⁻¹cm⁻¹。
- DETTD:在DMTTD基础上引入两条支链烷基,实现“分子包裹”,有效抑制分子间作用,最终获得亮度高达117.5 M⁻¹cm⁻¹的纳米颗粒。
该策略在分子层面提升吸收能力,在聚集态下抑制荧光猝灭,形成了完整的设计范式。
📊三、理论计算与光物理性能分析
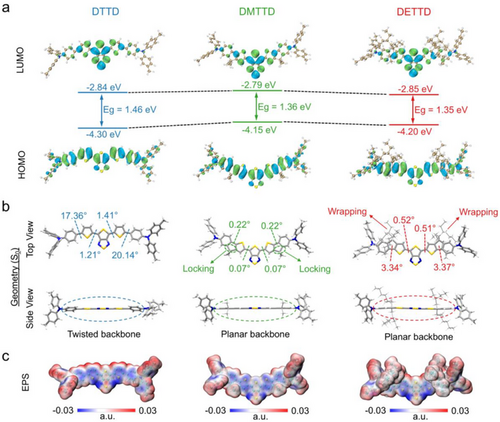
通过密度泛函理论(DFT)计算,研究发现:
- DETTD分子能级间隙为1.35 eV,较DTTD(1.46 eV)更小,有利于红移吸收。
- 分子几何结构更趋平面化,π共轭增强,吸收强度提升。
- 电势图显示DETTD表面电荷分布均匀,支链有效阻止分子间紧密堆积。
光谱测试结果表明:
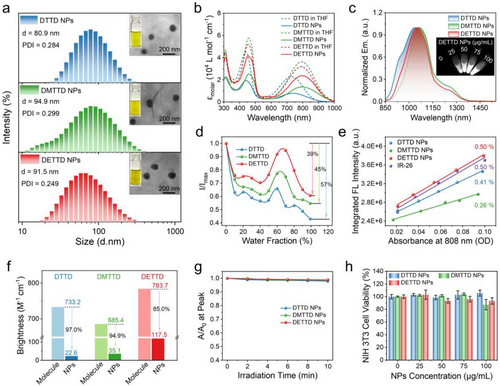
- DETTD在THF中吸收峰位于794 nm,荧光发射峰在1060 nm,覆盖NIR-IIx区(1400–1500 nm)。
- 纳米颗粒尺寸均匀(80–100 nm),PDI < 0.3,适合体内应用。
- DETTD纳米颗粒在水中仍保持高吸收系数(2.35 × 10⁴ M⁻¹cm⁻¹)与良好荧光强度。
🧬四、抗猝灭机制验证:晶体学与分子动力学模拟
单晶结构分析显示:
- DMTTD晶体中分子紧密堆积,距离仅3.762 Å。
- DETTD晶体中存在两类二聚体,距离分别为3.565 Å与7.698 Å,支链有效阻止近距离堆积。
分子动力学模拟进一步证实:
- DETTD在水中形成松散聚集体,分子间距大于6 Å,猝灭作用显著减弱。
- 相比传统屏蔽策略(如氟烯端基),DETTD的中心包裹设计更具空间阻碍效果。
🧫五、体内成像表现:血管与胃肠道清晰可见
在小鼠体内成像实验中,DETTD纳米颗粒表现出卓越性能:
- 血管成像:使用1200 nm长通滤光片,DETTD成像对比度高,背景干扰少,FWHM仅0.057 mm。
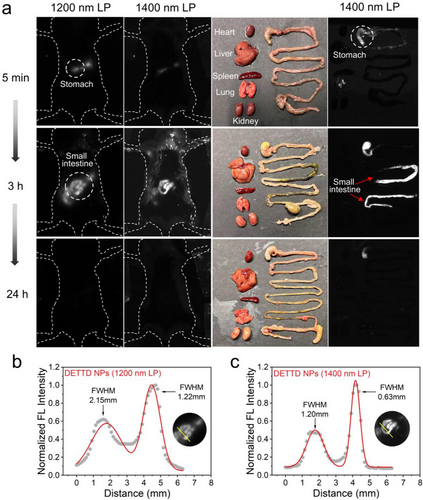
- 胃肠道成像:口服后3小时,小肠清晰可见,使用1400 nm滤光片成像分辨率更高,FWHM降至0.63 mm。
- 生物安全性:无明显ROS生成,细胞毒性低,24小时后基本清除,无器官蓄积。
这些结果表明,DETTD纳米颗粒不仅亮度高、稳定性好,还具备优异的生物相容性与成像能力。 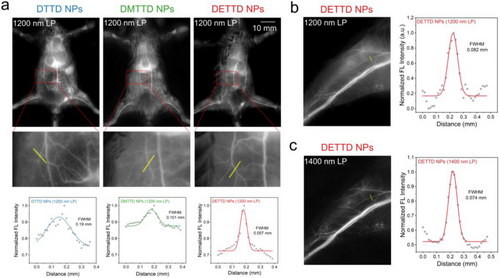
🎯六、总结与展望
本研究通过“分子锁定”与“分子包裹”双重策略,成功解决了NIR-II荧光材料在亮度提升上的两大难题:
- 提高吸收系数:骨架平面化增强π共轭。
- 抑制荧光猝灭:支链包裹阻止分子堆积。
最终开发出的DETTD纳米颗粒亮度高达117.5 M⁻¹cm⁻¹,在血管与胃肠道成像中表现出色,为高分辨率体内成像提供了新工具。该策略为未来NIR-II荧光材料的设计提供了通用范式,具有广泛的应用前景。
📌推荐关注:如果你对纳米医学、荧光成像或分子设计感兴趣,不妨持续关注这类高亮度材料的研究进展,它们正悄然改变精准医学的未来。
文章信息
📚文章标题:Achieving High-Brightness NIR-II Emission: Molecular Locking and Wrapping Strategies in Fluorescent Material Design for in Vivo Bioimaging 作者:Chun-Sing Lee 期刊:Advanced Materials 链接:https://doi.org/10.1002/adma.202510386