【Adv.Mater.】3重激活,79.7%肿瘤抑制率!新型表观遗传纳米激动剂打破PD-L1耐药瓶颈
近年来,免疫检查点抑制剂(如PD-1/PD-L1抗体)在肿瘤治疗中取得了显著进展,但仍有大量患者因肿瘤对PD-L1治疗产生耐药而无法获益。本文介绍了一种创新的表观遗传纳米激动剂(epigenetic nanoagonist),通过三重机制——T细胞激活、招募与再激活,显著提升了对PD-L1耐药肿瘤的治疗效果,在多种模型中实现了高达79.7%的肿瘤抑制率。 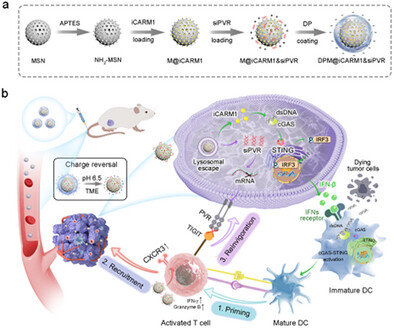
文章信息
📚文章标题:An Epigenetic Nanoagonist Facilitates T Cell Priming, Recruitment, and Reinvigoration in Tumors Resistant to PD-L1 Therapy 作者:Xiaojiao Li等 期刊:Advanced Materials 链接:https://doi.org/10.1002/adma.202502800
一、PD-L1耐药的三大障碍
PD-L1耐药肿瘤的治疗困难主要源于以下三点:
- T细胞激活不足:肿瘤微环境中树突状细胞(DC)未能充分成熟,导致T细胞无法有效识别肿瘤抗原。
- T细胞招募受限:关键趋化因子受体CXCR3表达不足,使得T细胞难以迁移至肿瘤部位。
- T细胞功能衰竭:肿瘤细胞表达替代免疫检查点PVR,与TIGIT结合抑制T细胞活性。
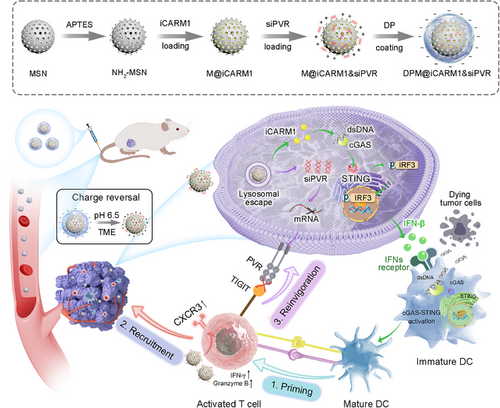
二、纳米平台设计:精准递送双重药物
研究团队构建了一种pH响应性电荷反转纳米平台,核心结构为氨基功能化介孔二氧化硅(NH₂-MSN),外层包裹可在酸性肿瘤环境中解离的DA-PEG(DP)涂层。该平台可同时递送:
- CARM1抑制剂(iCARM1):在肿瘤细胞中激活cGAS-STING通路,促进DC成熟;在T细胞中上调CXCR3,增强招募。
- PVR siRNA(siPVR):沉默肿瘤细胞中的PVR表达,解除TIGIT介导的免疫抑制。
该平台在pH 6.5条件下迅速释放药物,12小时内释放率达77%,并成功实现溶酶体逃逸。 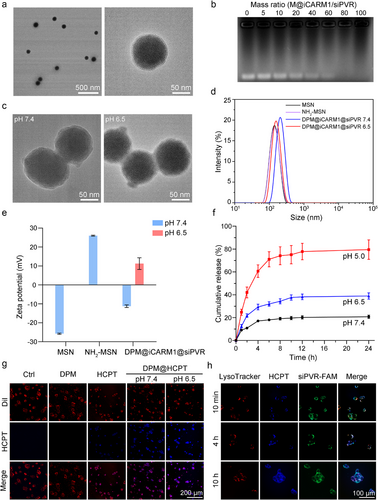
三、三重机制激活T细胞免疫
1. 激活:cGAS-STING通路驱动DC成熟
iCARM1在肿瘤细胞中诱导双链DNA积累,激活cGAS-STING通路,显著提升IFN-β分泌,促进DC表达CD80/CD86等成熟标志物。成熟DC进一步增强抗原呈递能力,使CD8⁺ T细胞活化率提高2.99倍,IFN-γ与GZMB表达显著增强。 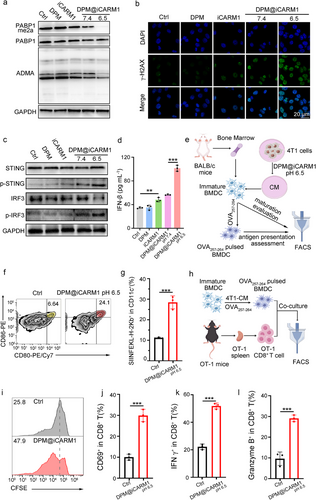
2. 招募:CXCR3上调引导T细胞迁移
在T细胞中,iCARM1抑制CARM1后显著上调CXCR3表达,增强其向肿瘤部位迁移能力。实验显示,CXCR3⁺ T细胞比例显著增加,杀伤肿瘤细胞的能力同步提升。 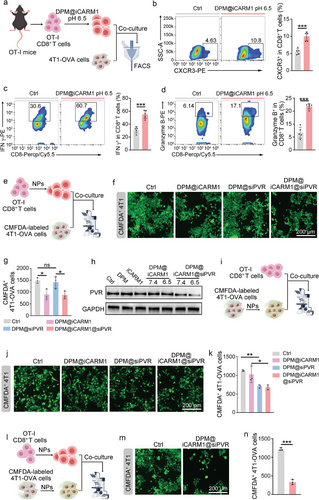
3. 再激活:siPVR解除免疫抑制
siPVR有效沉默肿瘤细胞中的PVR表达,阻断其与TIGIT的结合,显著增强T细胞的杀伤活性。联合处理肿瘤细胞与T细胞后,肿瘤细胞几乎被完全清除,显示出强大的协同效应。
四、体内验证:79.7%肿瘤抑制率与长期免疫记忆
在4T1三阴性乳腺癌小鼠模型中,联合递送iCARM1与siPVR的纳米平台(DPM@iCARM1@siPVR)实现了: 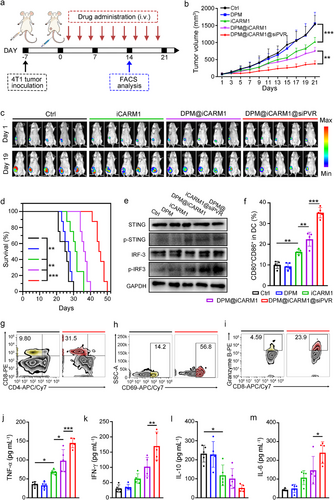
- 79.7%肿瘤体积减少,显著优于单药治疗组;
- 生存期延长至45天,对比对照组的25天;
- 免疫细胞重塑:CD8⁺ T细胞、NK细胞显著增加,Treg与MDSC显著减少;
- 炎症因子上调:TNF-α、IFN-γ、IL-6升高,IL-10下降,表明免疫环境被有效激活。
此外,在术后复发与转移模型中,DPM@iCARM1@siPVR完全阻止了肿瘤复发与远处转移,并诱导了中央记忆T细胞(Tcm)生成,在二次肿瘤挑战中展现出强大的免疫保护力。
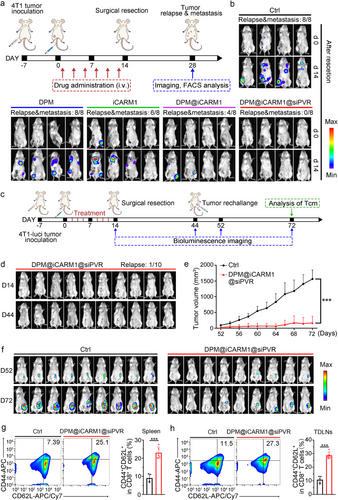
五、广泛适用性与临床潜力
该纳米激动剂在CT26结肠癌模型中同样展现出显著疗效,进一步验证了其在多种PD-L1耐药肿瘤中的广泛适用性。与PD-L1抗体联合使用时,肿瘤抑制率高达92.6%,显示出良好的协同潜力。 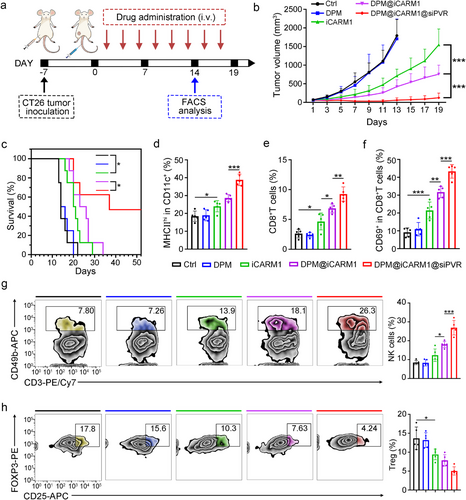
研究还指出,该平台具备以下优势:
- 快速电荷反转机制(1小时内由−11.2 mV转为+14.1 mV);
- 高药物负载与释放效率;
- 良好的生物相容性与安全性;
- 可规模化合成,具备临床转化潜力。
六、结语:多维免疫激活,开启耐药肿瘤治疗新篇章
本研究提出的表观遗传纳米激动剂通过“三重激活”策略,有效解决了PD-L1耐药肿瘤治疗中的关键障碍。其在多个模型中展现出的强大免疫激活能力与长期保护效果,为未来肿瘤免疫治疗提供了全新思路与技术平台。
未来研究将聚焦于临床前大动物验证、长期毒理评估与siRNA规模化加载优化,推动该策略向临床应用迈进。