【Adv.Mater.】突破骨髓屏障的“8×10¹¹”纳米战队:骨髓间充质干细胞膜仿生纳米囊泡的精准递送革命
骨病治疗长期面临药物难以穿透骨髓-血液屏障(MBB)的难题。近日,《Advanced Materials》发表的一项研究提出了一种创新策略:利用骨髓间充质干细胞(BMSCs)膜构建仿生纳米囊泡(mNVs),实现对骨髓的高效靶向药物递送。这项研究不仅在骨质疏松和乳腺癌骨转移模型中展现出卓越疗效,还为未来骨病治疗提供了可规模化生产的新平台。 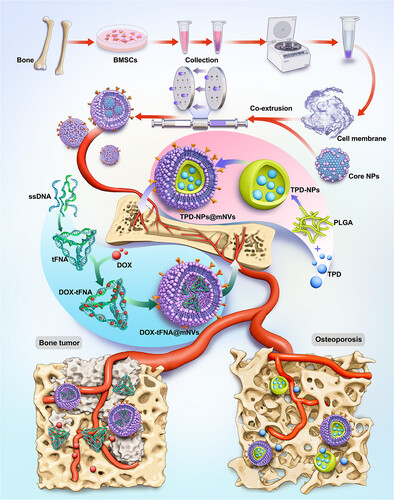
文章信息
📚文章标题:Engineered Biomimetic Nanovesicles Derived From Bone Marrow Stromal Cells With Innate Homing Capability for Targeted Delivery 作者:Yunfeng Lin 期刊:Advanced Materials 链接:https://doi.org/10.1002/adma.202505714
🧠研究背景:骨病治疗的“屏障困境”
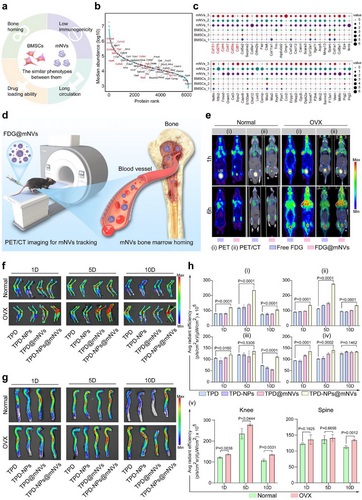
骨组织血液灌注差,MBB作为天然屏障,限制了药物的有效递送。传统纳米载体虽具一定靶向性,但仍难以突破MBB。BMSCs具备天然归巢能力,能穿透骨髓屏障并聚集于骨组织,因此其细胞膜成为理想的仿生材料来源。
🧪技术核心:8×10¹¹个仿生囊泡的构建与验证
研究团队从BMSCs提取细胞膜,通过超速离心和共挤压技术,成功构建出约8×10¹¹个mNVs。这些囊泡保留了关键膜蛋白(如CD47和CD44),具备免疫逃逸和骨髓归巢能力。通过透射电子显微镜(TEM)、原子力显微镜(AFM)和蛋白质组学分析,验证了囊泡的结构完整性和功能保留。 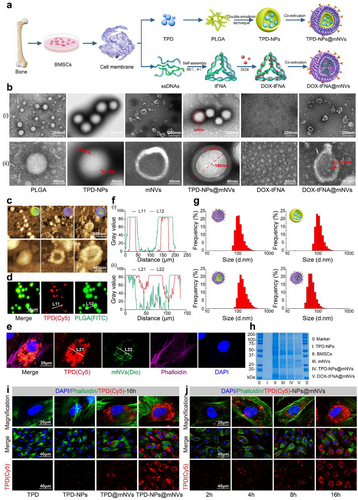
💊双重治疗模型:骨质疏松与乳腺癌骨转移
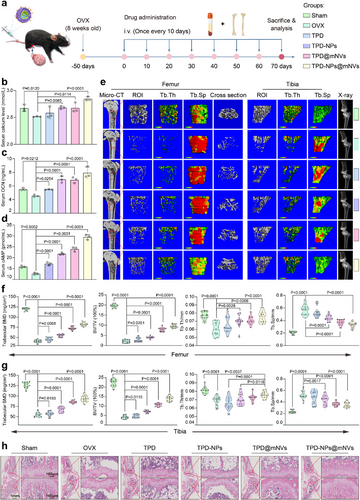
1. 骨质疏松模型:TPD-NPs@mNVs的持续释放系统
- 药物核心:TPD(甲状旁腺激素1-34)负载于PLGA纳米颗粒中
- 功能机制:mNVs包裹TPD-NPs后形成持续释放系统,药物释放可达10天以上
- 治疗效果:
- 显著提升血清钙、骨钙素(OCN)和cAMP水平
- 微CT显示骨密度、骨体积分数、骨小梁厚度等指标全面改善
- 组织染色(HE、Masson)显示骨小梁结构重建、胶原纤维分布恢复
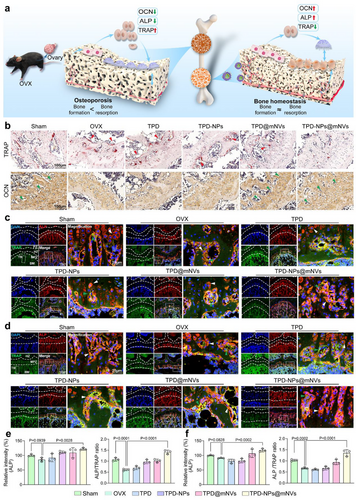
- 骨代谢平衡恢复,TRAP阳性破骨细胞减少,ALP阳性成骨细胞增加
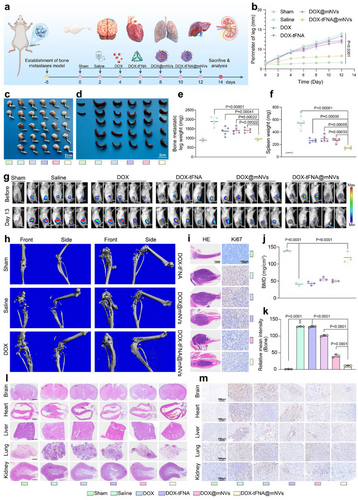
2. 乳腺癌骨转移模型:DOX-tFNA@mNVs的酸性触发释放系统
- 药物核心:DOX(阿霉素)嵌入DNA四面体结构(tFNA)
- 功能机制:在肿瘤微环境酸性条件下快速释放DOX,减少血液中药物泄漏
- 治疗效果:
- 显著抑制肿瘤生长,腿部肿瘤体积和重量明显下降
- 骨质破坏减少,骨密度维持良好
- Ki67免疫组化显示肿瘤增殖显著受抑
- 脾脏肿大减轻,提示炎症反应降低
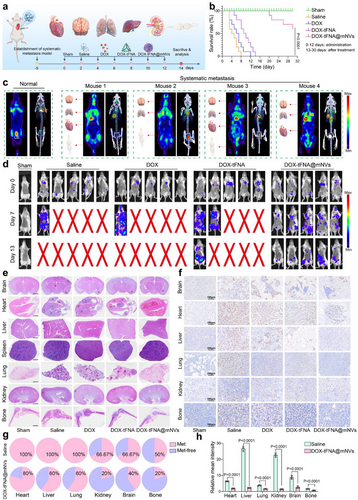
🌍系统性转移模型:DOX-tFNA@mNVs延长生存时间
在4T1-Luc乳腺癌系统性转移模型中,DOX-tFNA@mNVs展现出卓越的抗肿瘤效果:
- 生存时间显著延长
- 微PET/CT显示FDG@mNVs在脑、肺、心脏等器官聚集,体现肿瘤归巢能力
- 多器官病理检查显示转移灶减少,Ki67表达降低
- 骨髓靶向性增强,药物在骨组织中持续释放
🛡️安全性评估:低毒性与良好生物相容性
- TPD-NPs@mNVs在70天治疗后无明显毒性,血液指标和器官组织正常
- DOX-tFNA@mNVs相比自由DOX显著降低白细胞减少和肝肾毒性
- mNVs的低免疫原性和长循环特性为临床转化提供保障
🔄未来展望:多功能平台的无限可能
- mNVs可负载多种核心材料(siRNA、蛋白、多肽、中药单体等)
- 可通过表面修饰增强肿瘤特异性(抗体、适配体、肽段)
- 有望应用于骨髓炎、类风湿性关节炎等其他骨病
- 需进一步研究归巢机制及临床转化挑战(免疫抑制、储存条件等)
🧩结语:从细胞膜到精准治疗的“纳米跃迁”
本研究以BMSCs膜为基础,构建出具有骨髓归巢能力的仿生纳米囊泡,实现了对骨病和肿瘤的精准治疗。TPD-NPs@mNVs和DOX-tFNA@mNVs不仅在动物模型中展现出卓越疗效,也为未来个性化药物递送和骨病治疗开辟了新路径。这一“8×10¹¹”纳米战队,或将成为骨病治疗领域的革命性力量。